Karcinomy hlavy a krku – vlivy HPV infekce
Přehledové sdělení
Souhrn: Onkologická onemocnění obecně jsou v České republice druhou nejčastější příčinou úmrtí za chorobami kardiovaskulárního aparátu. Skupina nádorů souhrnně označovaná jako nádory hlavy a krku (jedná se o nádory dutiny ústní a jazyka, dutiny nosní, paranasálních dutin, faryngu, laryngu a slinných žláz) tvoří asi 5 % všech zhoubných nádorů. Kromě slinných žláz jde v 95 % o spinocelulární karcinomy – tzv. head and neck squamous cell carcinoma (HNSCC). I přes dobrou dostupnost obličeje, krku a dutiny ústní pro klinické vyšetření, které by každý občan měl absolvovat při pravidelné prohlídce zubním lékařem jednou za půl roku, jsou často diagnostikovány až v pozdních klinických stadiích. Pochopení mechanismů vzniku karcinomů, jejich rizikových a predisponujících faktorů pomáhá jak v jejich diagnostice, tak i ve vývoji nových terapeutických postupů. Jedním z faktorů způsobujících HNSCC je infekce papilomaviry (human papilloma virus – HPV). V roce 2014 došlo na základě dat z klinických studií k několika změnám v pohledu na problematiku HPV infekce v onkologii.
Klíčová slova: HPV infekce, karcinomy hlavy a krku, kancerogeneze
Carcinoma of the head and neck – the effects of HPV infection
Review article
Summary: Oncological diseases in general are in the Czech Republic, the second most common cause of death after cardiovascular diseases. Group of tumours collectively referred to as cancers of the head and neck (the tumours of the oral cav ity and tongue, nasal cavity, paranasal sinuses, pharynx, larynx and salivary glands) make up about 5% of all malignant tumours. Excluding the salivary glands tumours, 95% of them are squamous cell carcinomas – head and neck squamous cell carcinoma (HNSCC). Despite the good accessibility of the face, neck and oral cavity for a clinical examination, which everybody should undergo regularly at the dentist inspection every six months, are often diagnosed in the late clinical stages. Understanding the mechanisms of cancerogenesis and cancer risk factors helps in their diagnosis and in the development of new therapeutic approaches. One of the factors responsible for HN SCC is infection by human papillomavirus (HPV). In 2014 was made, based on data from clinical studies, several changes in view of the problems of HPV infection in oncology.
Key words: HPV infection, head and neck cancer, carcinogenesis
Úvod
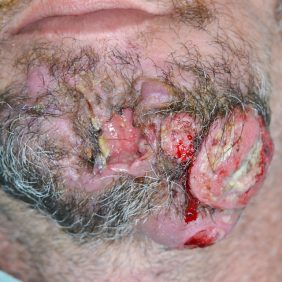
I když nejsou podrobnosti procesu vzniku a rozvoje zhoubných nádorů – kancerogeneze stále zcela prozkoumány, v případě spinocelulárních karcinomů, tzv. head and neck squamous cell carcinoma (HNSCC), je většina hlavních rizikových faktorů již dlouho známa (1). V drtivé většině případů se jedná o starší pacienty s nízkým socioekonomickým statutem, katast rofální úrovní zubní hygieny a péče, chronické etyliky a kuřáky (2, 3). Kombinace typických klinických příznaků (ulcerace sliznice, dysfagie, kontraktura, krvácení, foetor ex ore aj.) a habitu pacienta umožňovala stanovit klinickou diagnózu zhoubného nádoru dutiny ústní se značnou jistotou (obr. 1).
V posledních cca 25 letech se ale skladba pacientů postižených HNSCC pozvolna mění. Přibývají pacienti v mladším věku, abstinenti a nekuřáci v dobrém celkovém stavu s vyšším stupněm vzdělání. Většinou jsou to nositelé chronické infekce papilomaviry – human papilloma virus (HPV) (4). Tento fenomén je nejvíce patrný v USA, kde dlouhodobě klesá počet kuřáků, ale počet pacientů s HNSCC naopak roste (5). Je to dáno i změnami v sexuálním chování – např. cca dvojnásobný vzestup praktikování oro-genitálního styku v posledních třiceti letech (6, 7). Část HNSCC je – stejně jako u karcinomů děložního čípku, kde je s HPV infekcí asociováno 75–90 % prekanceróz a invazivních karcinomů (8) – důsledkem sexuálně přenosné infekce.
Největší podíl HPV pozitivních karcinomů je u nádorů tonzil a orofaryngu (pozn. autora: anatomicky oblast aborálně za hrazenými papilami jazyka). V oblasti samotné dutiny ústní tvoří HPV pozitivní karcinomy sice podstatně menší, stále ale ne zanedbatelnou část.
Přesně vyčíslit podíl HPV+ karcinomů není snadné, roli hraje mimo jiné i metoda detekce viru ve vzorku. Přítomnost HPV lze detekovat přímo v nakažených buňkách pomocí metod PCR (polymerázová řetězová reakce) nebo in situ hybridizací. PCR je používanější vzhledem k její jednoduchosti a dostupnosti komerčních setů. Nevýhodou je omezená specifita metody a z ní plynoucí možnost falešně pozitivních výsledků. Další možností je nepřímá detekce imunohistochemickým barvením proteinu p16. Ten vzniká jako reakce na přítomnost virového proteinu E7. Výsledky získané různými metodami není snadné vzájemně porovnávat pro jejich rozdílnou senzitivitu a specifitu (9). Udává se, že HPV infekce je zodpovědná asi za 50 % karcinomů tonzil, 35 % karcinomů orofaryngu a za 25 % karcinomů dutiny ústní (spodina i jazyk) i laryngu (10). HPV infekce znamená 15x větší riziko rozvoje karcinomu tonzil oproti nenakažené populaci – tzv. odds ratio (OR). Pro karcinom orofaryngu je OR 4,3 a pro dutinu ústní 2 (11).
Kancerogeneze
Kancerogeneze je přeměna „normální“ buňky na buňku nádorovou. V principu jde o mutace genů buď strukturních – buňka produkuje bílkovinu, která má odlišné vlastnosti, nebo regulačních – v buňce jsou aktivovány jinak neaktivní (proonkogeny) nebo deaktivovány jinak aktivní geny (tumor supresorové geny). Buňka pak získává například schopnost neomezeného dělení nebo ztrácí schopnost apoptózy. Všechny buňky procházejí během svého života alespoň částí buněčného cyklu. Kancerogeneze je v podstatě důsledek poruch regulace buněčného cyklu.
Buněčný cyklus se dělí na 4 základní fáze:
- G1 fáze (cca 50 % cyklu): zdvojení buněčné hmoty, buňka roste, tvoří se RNA a proteiny, připravuje se zásoba nukleotidů a enzymů pro replikaci DNA. G1 fáze obsahuje hlavní kontrolní uzel.
- S fáze (cca 30 % cyklu): DNA se replikuje na dvojnásobné množství, každý chromozom je na konci této fáze zdvojený, buňka je tetraploidní.
- G2 fáze (cca 15 % cyklu): zdvojování organel, tvorba struktur potřebných pro dělení buňky – mitotické vřeténko.
- M fáze (mitóza, cca 5 % cyklu): dělení jádra (karyokineze), dělení buňky (cytokineze), výsledkem jsou dvě buňky o stejném počtu chromozomů.
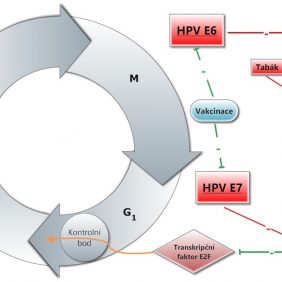
Buněčný cyklus obsahuje několik kontrolních bodů. Průchod kontrolními body a celý cyklus je regulován cykliny a cyklin dependentními kinázami (CDK). Hlavní kontrolní uzel na přechodu G1/S fáze = restrikční bod uvádí většinu buněk do G0 fáze, ve které se buňka nepřipravuje na dělení. V jiných případech (poškození genomu) buňka nepokračuje v cyklu a zaniká apoptózou. Přechod z G1 do S fáze je řízen především činností proteinu p16 (CDI-p16, CDK inhibitor p16). Tento protein inhibuje CDK4/6, která poté nemůže interagovat s cyklinem D1 a umožnit tak pokračování buněčného cyklu. Stimulace buňky růstovými faktory nebo onkogeny vede ke zvýšení exprese cyklinu D1. Jakmile vzniknou aktivní komplexy CDK4/6-cyklin D1, fosforylují (navázání fosfátové skupiny vedoucí k deaktivaci) tumor – supresorový protein pRB (retinoblastom), čímž se následně aktivuje dosud inhibovaný transkripční faktor E2F. K hlavnímu kontrolnímu bodu má vztah mnoho tumor supresorových faktorů (p53, pRB, p16, p21) i proonkogenních faktorů (proteiny HPV) (12).
Genetické poruchy vedoucí k deregulaci buněčného cyklu a rozvoji zhoubného bujení mohou být způsobeny různými vyvolávajícími faktory – kancerogeny. Dlouho jsou známy fyzikální a chemické kancerogeny. Pro oblast hlavy a krku jsou nejdůležitější různé druhy ionizujícího a UV záření, složky tabáku a alkohol (2, 3, 13, 14, 15). Malá část nádorů, 5 – 10 %, vzniká čistě na dědičném podkladě (retinoblastom, Wilmsův nádor ledvin, nádory u dědičných syndromů) (16). Pro některé nádory se dědí dispozice – karcinomy prsu a vaječníků u nositelek mutací genů BRCA1 a BRCA2.
Nezanedbatelnými kancerogeny jsou i viry. Virová etiologie karcinomů děložního čípku je dobře známa, za její objev obdržel německý virolog Harald zur Hausen v roce 2008 Nobelovu cenu za fyziologii a lékařství (17). V případě HNSCC se jedná o příbuznou problematiku (18). Tzv. high-risk kmeny HPV, zejména kmeny 16 a 18, produkují během svého životního cyklu uvnitř napadené buňky mimo jiných i proteiny E6 a E7 (19). Ty mají schopnost inaktivovat důležité tumor supresorové proteiny p53 a pRB (20) (obr. 2). Jedná se o proteiny, které kontrolují buněčný cyklus a zabraňují neregulovanému dělení buněk. Pro růst HPV pozitivních HNSCC je důležitá trvalá exprese proteinů E6 a E7. Pokud infikovaná buňka ztratí kontrolu nad svým buněčným cyklem, začne se nekontrolovaně dělit a produkovat své vlastní kopie. To je primárním cílem HPV. Viry obecně nemají schopnost samostatné reprodukce. Množí se tak, že se jejich genetická informace připojí k jádru infikované buňky a poté se rozmnožuje spolu s buňkou a jejími dceřinými buňkami. Zablokovat regulaci buněčného cyklu a donutit napadenou buňku k nekontrolovanému množení je tedy z pohledu viru velice výhodná strategie. Vedlejším výsledkem je vznik nádoru z nakažených, autonomně se množících buněk.
Onkogenních proteinů produkují high-risk kmeny HPV více, příkladem může být protein E5. Ten mimo jiné snižuje imunitní odpověď organismu vůči napadeným buňkám (21). Důležitý význam má antionkogenní protein p16. Jedná se o inhibitor cyklin dependentní kinázy a inhibitor fosforylace pRB, který reguluje buněčný cyklus na přechodu mezi fázemi G1 a S. Jeho inaktivace je spojována s kouřením (22, 23). U pacientů s diagnostikovaným HNSCC HPV pozitivních, p16 pozitivních a zároveň nekuřáků je popisována lepší odpověď na léčbu a celková prognóza. Předpokládalo se, že u nich bude v budoucnu možné zmenšit intenzitu protinádorové léčby.
Vliv HPV infekce na průběh onemocnění
Bylo prokázáno, že HPV pozitivita je nezávislý rizikový faktor pro rozvoj HNSCC. Na druhé straně, u pacientů bez dalších rizikových faktorů (nekuřáci) je zdokumentována lepší odpověď na onkologickou terapii i delší celkové přežití (24). Důvodem je jednak jejich většinou lepší celkový zdravotní stav a také fakt, že maligní transformace buněk vznikla na podkladě zevní infekce a ne vlivem mutací v genomu postižených buněk. Buňky HPV pozitivních karcinomů mají regulační proteiny zablokované virovými bílkovinami, ale jejich genetická výbava bývá nepoškozená (to je důležité hlavně v případě p53). Lepší léčebná odpověď HPV pozitivních nádorů vedla k diskusím o nejlepší léčebné strategii u těchto pacientů.
Základní léčebnou modalitou i pokročilých HNSCC zůstává chirurgie. Vzhledem k faktům, že diagnóza je mnohdy stanovena v pokročilejších stadiích, s krčními metastázami, často se jedná o nízko diferencované invazivní karcinomy, není samotný chirurgický výkon většinou dostatečný (25, 26). Vysoce radikální, mutilující a invalidizující výkony také nejsou vhodné pro mladší pacienty s lepší prognózu a předpokládanou dlouhou dobou dožití. Standardní adjuvantní léčbou pro HNSCC je chemoradioterapie s cisplatinou/karboplatinou. To je však velmi toxický režim s množstvím akutních i pozdních nežádoucích účinků (např. těžká nefrotoxicita a ototoxicita, pro které až 40 % pacientů neabsolvuje kompletní léčbu) (27). U vybraných pacientů je navrhován přechod k bioradioterapii – nahrazení cisplatiny cetuximabem (Erbitux – Merck KGaA), chimerickou monoklonální protilátkou proti receptoru epidermálnímu růstovému faktoru (EGFR) (28, 29). Spinocelulární karcinomy mají běžně vysokou expresi EGFR. Tento receptor stojí na počátku tyrozinkinázové signální dráhy, která spouští zejména proliferaci epiteliálních buněk. Výhodou cetuximabu proti konvenčním cytostatikům je nižší toxicita, časté jsou pouze kožní reakce, možná je i alergická reakce (30). Léčebné protokoly s cetuximabem zatím nejsou oficiálně doporučeny a v ČR zatím běžně hrazeny zdravotními pojišťovnami (31).
V průběhu roku 2014 byly publikovány výsledky několika studií o vlivu HPV a p16 na prognózu a léčebnou odpověď, které poněkud upravily původní představy o modifikaci léčebné strategie u HPV+ HNSCC. Retrospektivní studie EX TRE ME (Erbitux in First-Line Treatment of Recurrent or Metastatic Head and Neck Cancer) ukázala, že přidání cetuximabu ke standardní chemoterapii (cisplatina/5-flourouracil) zlepšuje výsledky léčby jak u HPV+ tak i u HPV- pacientů s pokročilým HNSCC. Cetuximab by tedy měl být podáván všem pacientům s pokročilým HNSCC (32). I další studie ukázaly, že by cetuximab měl být podáván všem pacientům s lokálně pokročilým HNSCC bez ohledu na stav HPV. Stupeň exprese EGFR a tím i odpověď na léčbu cetuximabem není v praxi, na rozdíl od studií in vitro, přímo závislý na stavu HPV a p16 (33, 34).
Studie DAHANCA 18 (Danish Head & Neck Cancer Group) prokázala, že příznivou prognózu, ve srovnání s HPV-, mají pouze HPV+ karcinomy vycházející z orofaryngu. U karcinomů jiných lokalizací nemá HPV pozitivita nebo negativita vliv na přežití ani na léčebnou odpověď. Podle výsledků této studie by se nyní navrhovaná alternativní léčebná schémata neměla používat u jiných než HPV+ orofaryngeálních karcinomů. V této studii byl používán léčebný protokol bez cetuximabu, jednalo se o radioterapii s podáním nimorazolu a ci splatiny (35).
Úloha vakcinace
Po průkazu virové etiologie drtivé většiny karcinomů děložního hrdla začal vývoj vakcín proti HPV infekci. Nyní jsou běžně dostupné dvě očkovací látky: bivaletní (chrání proti HPV 16 a 18) Cervarix (GlaxoSmithKline Biologicals s. a.) a kvadrivaletní (HPV 6, 11, 16 a 18) Silgard (Merck Sharp & Dohme Ltd.). V ČR zdravotní pojišťovny hradí vakcinaci dívek mezi 13 a 14 lety. Předpokládá se, že postupná proočkovanost populace (zvažuje se i očkování chlapců, kteří působí jako přenašeči infekce) proti HPV povede k eliminaci až 95 % cervikálních karcinomů. Další posun by mohlo znamenat zavedení nové, 9valentní vakcíny (HPV 6, 11, 16, 18, 31, 33, 45, 52 a 58), která je momentálně testována pod kódem V503 (36). U HNSCC není situace tak optimistická, protože jejich velká část je způsobena jinými vlivy než HPV (37).
Závěr
V budoucnu se dá očekávat opětovný pokles HPV pozitivních HNSCC v důsledku tzv. očkování proti karcinomu děložního čípku – jedná se o vakcinaci proti high-risk kmenům HPV. Tento efekt se však projeví až za několik dekád. Nyní je třeba dořešit možnost použití alternativních, méně zatěžujících léčebných protokolů pro HPV pozitivní pacienty trpící HNSCC. Aktuální je i otázka imunoterapie HPV+ karcinomů, protože viry HPV vzhledem ke svému intracelulárnímu životnímu cyklu způsobují jen slabou imunitní odpověď organismu. Zatím probíhající experimenty s terapeutickými vakcínami prokazují účinnost proti premaligním lézím cervixu.
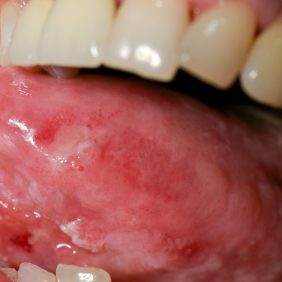
Nutné je zdůraznit, že onkologická prohlídka dutiny ústní je povinnou součástí periodických prohlídek u zubního lékaře a nelze ji považovat za formalitu. Zatímco tzv. „klasické karcinomy“ většinou praktický zubní lékař nediagnostikoval (tito pacienti často končili přímo na stomatochirurgických, ORL a onkologických pracovištích a u zubního lékaře nebyli vůbec registrováni), nebo bylo podezření na karcinom zjevné ihned po zběžné anamnéze (abúzus alkoholu a nikotinu ve vysokých dávkách po mnoho let), pacienti ohrožení HPV pozitivními karcinomy ordinacemi zubních lékařů často procházejí a na jejich anamnéze i životním stylu není nic nápadného (obr. 3). Mnohdy se jedná o pacienty velmi mladé, bez přidružených onemocnění, u kterých je diagnostikování zhoubného nádorového onemocnění velmi traumatizující. Proto je nutné soustředit se na jejich včasnou diagnostiku a následnou léčbu na specializovaných pracovištích.
Obrazová dokumentace
Literatura
1. Rothemberg M, Ellisen LW. The molecular pathogenesis of head and neck squamous cell carcinoma. Journal of Clinical Investigation, 2012, 6(122): 1951 – 1957. DOI 10.1172/JCI59889. Dostupné z: www.jci.org/articles/view/59889
2. Russo P, Cardinale A, Margaritora S, Cesario A. Nicotinic receptor and tobacco-related cancer. Life Sciences, 2012, 21 – 22(91): 1087 – 1092. DOI 10.1016/j.lfs.2012.05.003. Dostupné z: http://linkinghub.elsevier.com/retrieve/pii/S0024320512002627
3. Reidy J, McHugh E, Stassen LFA, et al. A review of the relationship between alcohol and oral cancer. The Surgeon, 2011, 9(5): 278 – 283. DOI 10.1016/j.surge.2011.01.010. Dostupné z: http://linkinghub.elsevier.com/retrieve/pii/S1479666X11000114
4. Nováková V, Laco J. Úloha lidského papillomaviru v karcinogenezi nádorů hlavy a krku. Klinická onkologie, 2008, 21(4): 141 – 148.
5. Dayyani F, Etzel CJ, Liu M, et al. Meta-analysis of the impact of human papillomavirus (HPV) on cancer risk and overall survival in head and neck squamous cell carcinomas (HNSCC). Head and Neck Oncology, 2010, 2(15): DOI 10.1186/1758 – 3284 – 2 – 15. Dostupné z: http://www.headandneckoncology.org/content/2/1/15
6. Marur S, D’Souza G, Westra WH, Forastiere AA. HPV- associated head and neck cancer: a virus-related cancer epidemic. The Lancet Oncology, 2010, 11(8): 781 – 789. Dostupné z: http://linkinghub.elsevier.com/retrieve/pii/S1470204510700176
7. Bajos N, Bozon M, Beltzer N, et al. Changes in sexual behaviours: from secular trends to public health policies. AIDS, 2010, 24(8): 1185 – 1191. Dostupné z: http://content.wkhealth. com/linkback/openurl?sid=WKPTLP:landingpage
8. Tjalma WA, Fiander A, Reich O, at al. Differences in human papillomavirus type distribution in high-grade cervical intraepithelial neoplasia and invasive cervical cancer in Europe. International Journal of Cancer, 2013, 132(4): 854 – 867. Dostupné z: http://doi.wiley.com/10.1002/ijc.27713
9. Jimenez AM, Ruttky-Nedecký B, Zítka O, Adam V, Kizek R. Human papilloma virus (HPV) and methods for its identification in head and neck cancers. Journal of Metallomics and Nanotechnologies. 2014, 1(4): 6 – 12.
10. Bisht M, Bist S. S. Human papilloma virus: A new risk factor in a subset of head and neck cancers. Journal of Cancer Research and Therapeutics, 2011, 7(3): 251 – 255. Dostupné z: http://www.cancerjournal.net/text.asp?2011/7/3/251/87004
11. Hobbs CGL, Sterne JAC, Bailey M, Heyderman RS, Birchall MA, Thomas SJ. Human papillomavirus and head and neck cancer: a systematic review and meta-analysis. Clinical Otolaryngology, 2006, 31(4): 259 – 266. Dostupné z: http://doi.wiley.com/10.1111/j.1749 – 4486.2006.01246.x
12. Lange CA, Yee D. Killing the second messenger: targeting loss of cell cycle control in endocrine-resistant breast cancer. In: Endocrine Related Cancer (online), 2011 – 07, 18(4): C19-C24 (cit. 2014 – 11 – 05). Dostupné z: http://erc.endocrinology-journals.org/cgi/doi/10.1530/ERC-11 – 0112
13. United Nations Scientific Committee on the Effects od Atomic Radiation. Effects of ionizing radiation: UNSCEAR 2006 report to the General Assembly, with scientific annexes. New York: United Nations, 2008.
14. Hecht SS. Progress and Challenges in Selected Areas of Tobacco Carcinogenesis. Chemical Research in Toxicology, 2008, 21(1): 160 – 171. Dostupné z: http://pubs.acs.org/doi/abs/10.1021/tx7002068
15. Salzman R. Vztah parametrů oxidativního stresu k onkologické charakteristice spinocelulárních karcinomů hlavy a krku. Brno, 2007. Disertační práce. Masarykova univerzita, Lékařská fakulta. Dostupné z: http://is.muni.cz/th/20399/lf_d/
16. Knudson AG. Mutation and Cancer: Statistical Study of Retinoblastoma. Proceedings of the National Academy of Sciences, 1971, 4(68): 820 – 823. Dostupné z: http://www.pnas.org/cgi/doi/10.1073/pnas.68.4.820
17. Hausen H. Papillomaviruses in the causation of human cancers — a brief historical account. Virology, 2009, 384(2): 245 – 261. Dostupné z: http://linkinghub.elsevier.com/retrieve/pii/S0042682208007721
18. Syrjänen K, Syrjänen S, Lamberg M, Pyrhönen S, Nuutinen J. Morphological and immunohistochemical evidence suggesting human papillomavirus (HPV) involvement in oral squamous cell carcinogenesis. International Journal of Oral Surgery. 1983, 12(6): 418 – 424. Dostupné z: http://linkinghub.elsevier.com/retrieve/pii/S0300978583800337
19. Miller DL, Puricelli MD, Stack SM. Virology and molecular pathogenesis of HPV (human papillomavirus) associated oropharyngeal squamous cell carcinoma. Biochemical Journal, 2012, 443(2): 339 – 353. DOI 10.1042/BJ20112017. Dostupné z: http://www.biochemj.org/bj/443/bj4430339.htm
20. Denaro N, Nigro CL, Natoli G, Russi EG, Adamo V, Merlano MC. The Role of p53 and MDM2 in Head and Neck Cancer. ISRN Otolaryngology, 2011(1): 1 – 8. DOI 10.5402/2011/931813. Dostupné z: http://www.hindawi.com/isrn/otolaryngology/2011/931813/
21. Váňová B, Golais F. Onkogénny potenciál papilomavírusov. Klinická onkologie, 2013, 26(6): 399 – 403.
22. Rischin D, Young RJ, Fisher R, et al. Prognostic Significance of p16INK4A and Human Papillomavirus in Patients With Oropharyngeal Cancer Treated on TROG 02.02 Phase III Trial. Journal of Clinical Oncology, 2010, 28(27): 4142 – 4148. Dostupné z: http://jco.ascopubs.org/cgi/doi/10.1200/JCO.2010.29.2904
23. Čáslava T. Abnormální exprese regulátorů buněčného cyklu jako prediktivní faktor u spinocelulárního karcinomu jazyka a spodiny dutiny ústní. Brno, 2007. Disertační práce. Masarykova univerzita, Lékařská fakulta. Dostupné z: http://is.muni.cz/th/48836/lf_d/
24. Vermorken JB, Psyrri A, Mesia R, et al. Impact of tumor HPV status on outcome in patients with recurrent and/or metastatic squamous cell carcinoma of the head and neck receiving chemotherapy with or without cetuximab: retrospective analysis of the phase III EXTREME trial. Annals of Oncology (online), 2014 (cit. 2014 – 03 – 24). DOI 10.1093/annonc/mdt574. Dostupné z: http://annonc.oxfordjournals.org/cgi/doi/10.1093/annonc/mdt574
25. Psyrri A, Boutati E, Karageorgopoulou S. Human papillomavirus in head and neck cancers. Anti- Cancer Drugs, 2011, 22(7): 586 – 590. Dostupné z: http://content.wkhealth.com/linkback/openurl?sid=WKPTLP:landingpage
26. Licitra L, Perrone F, Bossi P, et al. High-Risk Human Papillomavirus Affects Prognosis in Patients With Surgically Treated Oropharyngeal Squamous Cell Carcinoma. Journal of Clinical Oncology, 2006, 24(36): 5630 – 5636. DOI 10.1200/JCO.2005.04.6136. Dostupné z: http://www.jco.org/cgi/doi/10.1200/JCO.2005.04.6136
27. Mechl Z. HPV a karcinom orofaryngu z pohledu onkologa. Postgraduální medicína (online), 2012(7) (cit. 7. 12. 2014). Dostupné z: http://zdravi.e15.cz/clanek/postgradualni-medicina/hpv-a-karcinom-orofaryngu-z-pohledu-onkologa-466761
28. Licitra L, Bergamini C, Mirabile A, Granata R. Targeted therapy in head and neck cancer. Current Opinion in Otolaryngology, 2011, 19(2): 132 – 137. DOI 10.1097/MOO.0b013e328344b668. Dostupné z: http://content.wkhealth.com/linkback/openurl?sid=WKPTLP:landingpage
29. Mak MP, William WN. Targeting the epidermal growth factor receptor for head and neck cancer chemoprevention. Oral Oncology (online), 2014, 50(10): 918 – 923 (cit. 2014 – 12 – 08). Dostupné z: http://linkinghub.elsevier.com/retrieve/pii/S1368837513008129
30. Mechl Z, Abrahámová J. Postavení cetuximabu v léčbě pokročilých nádorů ORL oblasti. Remedia, 2006, 16(1): 110 – 115. Dostupné z: http://www.remedia.cz/Okruhy-temat/Imunologie/Postaveni-cetuximabu-v-lecbe-pokrocilych-nadoru-ORL-oblasti/8- 17-eq.magarticle.aspx
31. Vyzula R, a kol. Modrá kniha české onkologické společnosti. 18. Brno: Masarykův onkologický ústav, 2014.
32. Vermorken JB, Psyrri A, Mesia R, et al. Impact of tumor HPV status on outcome in patients with recurrent and/or metastatic squamous cell carcinoma of the head and neck receiving chemotherapy with or without cetuximab: retrospective analysis of the phase III EXTREME trial. Annals of Oncology, 2014, 25(4): 801 – 807. Dostupné z: http://annonc.oxfordjournals.org/cgi/doi/10.1093/annonc/mdt574
33. Pogorzelski M, Ting S, Gauler TC, et al. Impact of human papilloma virus infection on the response of head and neck cancers to anti-epidermal growth factor receptor antibody therapy. Cell Death and Disease (online), 2014, 5(2): 1091 – 1100 (cit. 2014 – 12 – 08). Dostupné z: http://www.nature.com/doifinder/10.1038/cddis.2014.62
34. Mirghani H, Amen F, Moreau F, et al. Oropharyngeal cancers: Relationship between epidermal growth factor receptor alterations and human papillomavirus status. European Journal of Cancer, 2014, 50(6): 1100 – 1111. Dostupné z: http://linkinghub.elsevier.com/retrieve/pii/S095980491301112X
35. Mechl Z, Brančíková D. Nové náhledy na roli lidského papilomaviru v léčbě nádorů hlavy a krku. Vnitřní Lékařství, 2014, 60(Supp. 2): 54 – 57.
36. Tlapáková J. Nádory hlavy a krku 2014: HNSCC: Otazníky kolem HPV, deeskalace léčby i imunoterapie. Zdravotnické noviny: Kongresový list (online), 2014(4) (cit. 2014 – 12 – 14). Dostupné z: http://www.zdravky.cz/kongresovy-list/aktualne/nadory-hlavy-a-krku-2014
37. Sehnal B, Vojáčková N, Driák D, et al. Předpokládaná účinnost HPV vakcinace v profylaxi nongenitálních karcinomů. Klinická onkologie, 2014, 27(4): 239 – 246. Dostupné z: http://www.linkos.cz/files/klinicka-onkologie/187/4513.pdf
19. 10. 2015
Print: LKS. 2015; 25(10): 198 – 202
Autoři:
Fotografie
- Archiv autorů
Rubrika:
Téma: