Problematika zubního ošetřování u pacientů léčených novými perorálními antikoagulancii
Praktické sdělení
Souhrn: V současné době se téměř denně setkáváme v naší odborné praxi s pacienty s farmakologicky navozenou poruchou hemostázy. Invazivní ošetřování takových pacientů s sebou přináší jistá specifika. Standardně a delší dobu u nás užívaná antitrombotika jsou odborné veřejností dobře známa a zkušeností s ošetřováním pacientů s touto léčbou je dostatek. Z důvodu některých nevýhodných vlastností zavedených léčiv byly zkoumány jiné možnosti zajištění bezpečnější a účinnější antikoagulace. Již několik let jsou po celém světě užívána takzvaná nová perorální antikoagulancia (new oral anticoagulants – NOAC), která přicházejí do širšího použití i u nás. V našem odborném sdělení je zpracována historie antikoagulační léčby a postupný vývoj až k NOAC, jsou popisovány základní vlastnosti u nás dostupných zástupců NOAC, a to i ve srovnání s konvenčními léčivy, a v neposlední řadě jsou shrnuty poznatky týkající se zubního ošetřování pacientů léčených NOAC.
Klíčová slova: antikoagulancium, faktory koagulační kaskády, hemostáza, NOAC, dabigatran, rivaroxaban, apixaban, edoxaban, idarucizumab, andexanet
The specifics of dental care for patients treated by the new oral anticoagulants
Professional article
Summary: We encounter patients with pharmacologically induced hemostasis impairment almost daily in our practice. An invasive treatment of these patients has its specifics. The antitrombotic drugs, that are used in our country for a long time period, are commonly well-known by the general proffessional public and the experience in the management of such patients is rich. Due to some unfavorable properties of established drugs, the other options to ensure a safer and more effective anticoagulation were explored. The so-called new oral anticoagu lants (NOAC) are used all over the world for several years and comes also into wider use in our country. The history of anticoagulant therapy and the progress to NO AC is presented in our article, we also mention the char acteristics of registered NOAC also in comparsion with conventional medicines and we summarize the findings regarding the dental treatment of patients treated by NOAC at the end.
Key words: anticoagulant, coagulation cascade factors, hemostasis, NOAC, dabigatran, rivaroxaban, apixaban, edoxaban, idarucizumab, andexanet
Úvod
Po celém světě, zejména v průmyslově vyspělých zemích, stoupá incidence kardiovaskulárních onemocnění (KVO). Hlavní příčinou úmrtí v USA se KVO stala již v roce 1945, v Evropě na KVO zemře ročně okolo 4 milionů lidí (podíl KVO na celkovém počtu úmrtí: muži 43 %, ženy 55 %). Asi jedna polovina úmrtí na KVO je v evropských zemích způsobena ischemickou chorobou srdeční (ICHS) a přibližně v jedné třetině případů je příčinou úmrtí cévní mozková příhoda (CMP). Česká republika v incidenci úmrtí na KVO nevybočuje z evropského průměru a i u nás jsou KVO nejčastější příčinou úmrtí (1). Pacienti trpící KVO často vyžadují trvalou antitrombotickou terapii. Z výše popsaného vyplývá, že se v naší stomatologické praxi budeme stále častěji setkávat s pacienty s farmakologicky navozenou poruchou hemostázy. Stomatologové byli již v minulosti seznamováni s problematikou ošetřování pacientů s antitrombotickou léčbou prostřednictvím mnohých odborných sdělení, v posledních letech se však stále více rozmáhají antitrombotika nové generace. Účelem našeho sdělení je seznámit čtenáře s novými trendy v léčbě KVO, vlastnostmi nových perorálních antikoagulancií (NOAC) a možnostmi a úskalími ošetřování pacientů léčených NOAC.
Historie antikoagulační léčby
Kumariny a hepariny byly donedávna jedinými přípravky používanými k léčbě a prevenci KVO v humánní medicíně (2). Heparin byl poprvé extrahován z jaterní tkáně psa v roce 1916 studentem medicíny Jay MacLeanem (Johns Hopkins Medical School, Baltimore, USA), ačkoliv termín „heparin“ byl poprvé užit americkým fyziologem Williamem Henry Howellem o dva roky později. Od konce 20. let 20. století se několik světových odborníků snažilo dosáhnout optimální purifikace při výrobě heparinu a zavést toto léčivo do klinického užití. První publikaci o použití heparinu jako antikoagulancia přednesli Murray a kol. v roce 1937 – prevence žilního tromboembolismu po mechanickém a chemickém poškození žil u psů (3). První užití v humánní medicíně se uskutečnilo téhož roku s dobrým výsledkem – prodloužení koagulačního času bez nežádoucích vedlejších efektů. První více či méně úspěšné léčebné pokusy provedli v roce 1941 McLean a kol. u pacientů trpících infekční endokarditidou a v roce 1946 McLean a Johnson u pacientů s ischemií dolních končetin. Do konce 70. let 20. století byl v klinické praxi užíván výlučně nefrakcionovaný heparin (unfractionated heparin – UFH), počátkem 80. let 20. století byl však vyvinut nízkomolekulární heparin (low-molecular-weight heparin – LMWH), který rozšířil a zvýšil využitelnost tohoto léčiva (4).
Ve 20. letech 20. století se začínají šířit zprávy o záhadném hynutí dobytka z oblasti prérií Kanady a severu USA, úmrtí nastávala z důvodu závažného vnitřního krvácení bez zjevné příčiny. Tato úmrtí byla zaznamenána u dobytka krmeného vlhkým senem s obsahem komonice (Melilotus alba, Melilotus officinalis) napadeného plísní Penicillium nigrican a Penicillium jensi. Následovalo pátraní po aktivní složce obsažené v nekvalitním krmivu, která působí tak závažné poruchy koagulace. Toto se podařilo až ve 40. letech 20. století, kdy byla poprvé extrahována uhlíkatá sloučenina 3,3'-metylen-bis[4 -hydroxykumarin] (5, 6, 7, 8). Výzkumy odhalily, že přírodní kumarin obsažený v komonici byl spolupůsobením plísní oxidován na látku dnes známou jako dikumarol. Tyto výzkumy probíhaly v institutu Wisconsin Alumni Research Foundation (WARF), který v roce 1941 získal patentová práva na dikumarol. Výzkumník Karl Link se zaměřil na vývoj přípravku s nejsilnějším antikoagulačním efektem, aby ho v roce 1948 uvedl na trh jako rodenticid pod názvem WARFARIN. Po prvotních úspěších v hubení hlodavců byl warfarin zkoumán i jako potenciální léčivo a následně i zaveden do klinické praxe v roce 1954 jako první perorálně užívané antikoagulans. Oproti heparinu měl jisté výhody – perorální administrace, dobrá rozpustnost ve vodě a vysoká biologická dostupnost po perorálním užití. Obtížnou se však ukázala monitorace efektu warfarinu, neboť tromboplastin užívaný k vyšetření protrombinového času (PT) nevykazoval vždy standardní vlastnosti. Tento problém byl vyřešen až v roce 1982, kdy WHO zavedla INR (international normalized ratio) (3, 9).
Antagonisté vitaminu K – kumarinové deriváty
Je známo několik typů antivitaminů K na bázi kumarinů, z čehož v současné době jediným registrovaným léčivem tohoto typu na našem trhu je warfarin. Dříve oblíbený PELENTAN (ethyl-biskumacetát) se dnes již kvůli nevýhodné farmakokinetice nepoužívá. Tato léčiva omezují tvorbu na vitaminu K závislých koagulačních faktorů II, VII, IX a X tím, že zamezí redukci a působení vitaminu K při syntézách těchto faktorů. V terapeutických dávkách brání v syntéze koagulačních faktorů o 30 až 50 % a současně redukuje i jejich biologickou aktivitu. Warfarin dosahuje plného účinku po 2 až 7 dnech, během nichž dochází k eliminaci koagulačních faktorů již přítomných v cirkulaci (4, 10).
Nežádoucím vedlejším efektem warfarinu je, že snižuje i tvorbu inhibitorů koagulace – proteinů C a S, a tím působí v počátku léčby paradoxně hyperkoagulační stav (11, 12,). Warfarin je stále zlatým standardem mezi perorálními antikoagulancii, i když jeho vlastnosti zdaleka nejsou ideální. Účinek kumarinů kolísá v závislosti na příjmu vitaminu K potravou (potravinové interakce), dále závisí na metabolickém stavu organismu a jsou i četné a významné lékové interakce (téměř 800 známých lékových interakcí) (13). Warfarin má dále poměrně nízký terapeutický index a terapeutická dávka je dosti individuální (14, 15). Kvůli těmto nežádoucím vlastnostem je poměrně obtížné dosáhnout stabilní terapeutické hladiny (hodnoty INR 2 – 3) a jsou nutné pravidelné kontroly INR k ideálnímu vytitrování dávky (16).
Hepariny
Hepariny jak ve formě nefrakcionované (UFH), tak ve formě frakcionované (LMWH) jsou celosvětově rozšířená léčiva ovlivňující koagulační kaskádu. Nefrakcionovaný heparin se váže na molekulu antitrombinu, čímž mnohonásobně zvyšuje její potenciál inhibovat trombin a další faktory Xa, IXa, XIa a XIIa (10, 17). S klesající molekulovou hmotností klesá schopnost heparinu ovlivňovat IIa – trombin, ale zůstává či dokonce narůstá schopnost inhibovat Xa. Faktor Xa již navázaný na protrombinázový komplex je hůře ovlivnitelný LMWH a inhibice vyžaduje vyšší koncentraci LMWH.
Oba typy heparinů jsou léčiva vysoce účinná v léčbě či prevenci trombózy, LMWH však vykazují některé výhodné vlastnosti: silnější antitrombotický efekt, větší bezpečnost (méně krvácivých příhod a vedlejších účinků), výhodnější dávkování (1 – 2x denně) (18). Monitorace míry antikoagulace navozené UFH a LMWH je možná pomocí aktivovaného parciálního tromboplastinového času (aPTT), respektive aktivity anti Xa. Účinky heparinu lze zvrátit podáním antidota – protamin sulfátu, nevýhodou oproti warfarinu je nemožnost perorální administrace (10).
Nová perorální antikoagulancia
(new oral anticoagulant – NOAC, direct oral anticoagulant – DOA)
Veškerá donedávna používaná antikoagulancia měla přes svůj nesporný přínos v léčbě KVO řadu nežádoucích vlastností. Zejména doposud zlatý standard v perorální antikoagulační léčbě warfarin je vzhledem k jeho bohatým interakcím, úzkému terapeutickému indexu a nestabilní terapeutické hladině poměrně problémové léčivo. I v případech dobré compliance se hladiny INR často pohybují mimo terapeutická rozmezí, v klinických studiích jde pouze o 65 % doby, po kterou je pacient léčen warfarinem, v terapeutickém rozmezí, v reálné praxi je situace ještě horší (19). Výše uvedené skutečnosti vedly ke snaze vytvořit nové léčivo, které by se svými vlastnostmi co možná nejvíce přiblížilo ideálnímu antikoagulanciu.
Vlastnosti ideálního antikoagulancia by měly být následující:
- vysoká specificita účinku v koagulační kaskádě
- rychlý a spolehlivý účinek
- široká terapeutická šíře
- parenterální i perorální aplikace
- fixní dávka bez nutnosti složité titrace
- bez nutnosti pravidelné monitorace
- bez lékových a potravinových interakcí
- možnost rychlého ukončení účinku (antidotum)
- příznivá ekonomika.
Nová perorální antikoagulancia některými svými vlastnostmi předčila warfarin, ale vlastností ideálního antikoagulancia se zatím bohužel dosáhnout nepodařilo. V řadě provedených klinických studií (např. MODEL, RE-NOVATE, RE-MOBILIZE, RE-COVER, REMEDY, RE-LY) byla porovnávána tato nová antikoagulancia s již zavedenými léčivy v řadě indikací a výsledky dokazují stejnou nebo často vyšší účinnost a bezpečnost (20, 21, 22). Proto lze očekávat větší rozšíření těchto léčiv v léčbě KVO v zavedených a do budoucna nejspíš i rozšířených indikacích.
Společnou vlastností všech NOAC je skutečnost, že vzhledem k prediktabilnímu farmakokinetickému profilu není třeba rutinní monitorace účinku (23, 24, 25). Jsou však výjimečné situace, kdy je třeba zhodnotit aktivitu léčiva (akutní krvácení, urgentní chirurgie, selhání léčby) (26). Testy užívané pro konvenční antikoagulancia jsou pro tento účel nevhodná, proto jsou vyvíjeny specifické testy pro jednotlivé přípravky, které zatím nejsou dostupné ve všech laboratořích a jsou poměrně nákladné.
Dabigatran etexilát (PRADAXA)
Jedná se o perorálně užívaný přímý reverzibilní inhibitor trombinu, v současnosti jediný dostupný na trhu. Spektrum indikací zahrnuje primární prevenci žilních tromboembolických příhod u dospělých pacientů, kteří podstoupili elektivní totální náhradu kyčelního nebo kolenního kloubu, prevenci cévní mozkové příhody a systémové embolie u rizikových dospělých pacientů s nevalvulární fibrilací síní, léčbu hluboké žilní trombózy a plicní embolie a prevenci jejich rekurence u dospělých pacientů. Přípravek je kontraindikován u pacientů s umělou srdeční chlopní vyžadujících antikoagulační léčbu.
Vyznačuje se rychlým nástupem účinku (maximální efekt se objevuje za 0,5–6 hodin po podání) a dlouhou dobou působení (plazmatický poločas 14–17 hodin). Tato skutečnost umožňuje užívat lék v jedné či dvou denních dávkách (1x 220 mg či 2x 150 mg) bez nutnosti monitorace účinku (19, 20, 21, 24).
Jeho první registrace proběhla v roce 2008. Dabigatran inhibuje jak volný trombin, tak i trombin navázaný na fibrin a trombinem navozenou agregaci krevních destiček. Dabigatran je substrátem efluxní pumpy – glykoproteinu P, proto se můžeme setkat se zvýšením hladiny dabigatranu o 50–150 % při současném podávání inhibitorů tohoto transportéru (verapamil, azolová antimykotika, amiodaron, klarithromycin). Z důvodu renální eliminace (80 % dabigatranu je eliminováno ledvinami) je zapotřebí opatrnosti u pacientů s renální insuficiencí – snížení dávky či úplná kontraindikace při poklesu clearance kreatininu pod 30 ml/min.
Dabigatran prodlužuje trombinový čas (TT), ekarinový čas (ECT) a aPTT. Kalibrovaný dilutovaný TT test (dTT test) HE MOCLOT poskytuje odhad koncentrace dabigatranu v plazmě, ECT umožňuje přímé měření aktivity přímých inhibitorů trombinu. Test aPTT je široce dostupný, ale má omezenou senzitivitu, poskytuje přibližný údaj o intenzitě antikoagulace dosažené dabigatranem (16, 24).
V případě potřeby zrušení antikoagulačního účinku dabigatranu není zatím k dispozici specifické antidotum. V případě menšího krvácení je doporučováno přerušení léčby dabigatranem a lokální ošetření krvácení, v případě závažnějších stavů a velkého krvácení nespecifický postup – zástava krvácení chirurgicky, úhrada krevních ztrát, dále lze použít koncentrát aktivovaného protrombinového komplexu (např. FEIBA), rekombinantní faktor VIIa (NOVOSEVEN), koncentráty koagulačních faktorů II, IX a X, nebo lze využít hemodialýzy (dabigatran se málo váže na plazmatické bílkoviny a za 2 hodiny lze odstranit přes 60 % léčiva). V případě předávkování se doporučuje co nejdříve podat aktivní uhlí, pokud byla poslední dávka dabigatranu ne déle jak před 2 hodinami (24, 27).
Rivaroxaban (XARELTO)
Tento přímý selektivní inhibitor faktoru Xa je v ČR registrován od roku 2008. Vyznačuje se rychlým nástupem účinku (Tmax 2 – 4 hod.) a jeho poločas eliminace je 7 – 11 hod. (28). Biologická dostupnost po perorálním podání odpovídá 60 – 80 %, obvyklé dávkování je 10 – 20 mg 1x denně. Zhruba 2/3 podaného množství látky podléhá metabolické přeměně v játrech za vzniku neaktivních metabolitů, zbylá 1/3 je vylučována ledvinami v aktivní formě (27, 28). Nepotřebuje ke svému efektu antitrombin a při dodržování doporučovaného dávkování není třeba účinek monitorovat (29, 30).
Nevýhodou je, že zatím není k dispozici specifické antidotum. Na rozdíl od warfarinu má minimum potravinových a lékových interakcí, nejvýznamnější lékové interakce jsou s léky indukujícími či inhibujícími cytochrom P 450 3A4 (CYP3A4) a glykoprotein P (azolová antimykotika, rifampicin, karbamazepin, barbituráty), účinek potencuje též současné podávání jiných antikoagulancií a antitrombotik (25, 27, 30).
Rivaroxaban je registrován pro tato použití: prevence aterotrombotických příhod u dospělých pacientů po akutním koronárním syndromu, prevence žilního tromboembolismu u dospělých pacientů podstupujících elektivní operativní náhradu kyčelního nebo kolenního kloubu, prevence cévní mozkové příhody a systémové embolizace u dospělých pacientů s nevalvulární fibrilací síní, léčba hluboké žilní trombózy a plicní embolie a prevence recidivující hluboké žilní trombózy a plicní embolie u dospělých (27).
Rivaroxaban prodlužuje PT, ale tento test může být ovlivněn i jinými faktory, kvantitativní vyšetření poskytují testy přímých inhibitorů Xa, např. Biophen DiXaI (31). Léčba krvácivých komplikací je obdobná jako u dabigatranu – tzn. nespecifická, s tím rozdílem, že se rivaroxaban váže na plazmatické bílkoviny a nelze využít hemodialýzy (26). Pokud se u pacienta plánuje invazivní chirurgický výkon, doporučuje se rivaroxaban vysadit minimálně 24 hodin před výkonem, obnova medikace by měla být co nejdříve, jakmile to situace dovolí (dostatečná hemostáza po výkonu).
Apixaban (ELIQUIS)
Apixaban je další u nás registrovaný vysoce selektivní přímý inhibitor faktoru Xa, registrace proběhla v roce 2011. Maximální plazmatické koncentrace dosahuje po 3–4 hodinách, biologický poločas je 10–14 hodin, je metabolizován podobně jako rivaroxaban, dávkování je 2x denně.
Spektrum indikací u tohoto přípravku je prevence žilních tromboembolických příhod u dospělých pacientů, kteří podstoupili elektivní náhradu kyčelního nebo kolenního kloubu, prevence cévní mozkové příhody a systémové embolie u dospělých rizikových pacientů s nevalvulární fibrilací síní a léčba hluboké žilní trombózy a plicní embolie a prevence jejich rekurence u dospělých pacientů. Lékové interakce, možnosti laboratorního vyšetřování a případná léčba krvácivých komplikací je srovnatelná s rivaroxabanem (32). Před invazivním chirurgickým výkonem by měl být apixaban vysazen minimálně 24 hodin před výkonem s nízkým rizikem krvácení a 48 hodin před výkonem se středním a vysokým rizikem krvácení (32, 33).
Edoxaban (LIXIANA)
Edoxaban je další přímý vysoce selektivní inhibitor faktoru Xa s perorální administrací, jeho registrace proběhla v červnu roku 2015 prováděcím rozhodnutím Evropské komise.
Přípravek se používá k prevenci cévní mozkové příhody a systémové embolie u dospělých pacientů s nevalvulární fibrilací síní s jedním nebo více rizikovými faktory, jako je například kongestivní srdeční selhání, hypertenze, věk nad 75 let, diabetes mellitus, předešlá cévní mozková příhoda či tranzitorní ischemická ataka. Dále je indikován k léčbě hluboké žilní trombózy a plicní embolie a prevenci jejich rekurence. Užívá se obvykle 60 mg jednou denně, v určitých případech (závažná porucha funkce ledvin, nízká tělesná hmotnost, současné užívání inhibitorů P-glykoproteinu) se dávka snižuje. Souběžná léčba jinými antikoagulancii je kontraindikována, kromě období převádění na jiná léčiva. Edoxaban přirozeně zvyšuje riziko krvácení a oproti kumarinům například zvyšuje riziko slizničního krvácení a anemie.
K nástupu léčebného antikoagulačního účinku dochází za 1 – 2 hodiny od podání, eliminační poločas je 10–14 hodin. Účinek edoxabanu nelze spolehlivě monitorovat používanými laboratornímy testy, lze ho pouze odhadnout pomocí kalibrované kvantitativní analýzy anti-Xa aktivity. Nevýhodou též je, že nemá specifická antidota. V případě potřeby snížení antikoagulačního efektu při chirurgické intervenci se doporučuje přípravek vysadit nejméně 24 hodin před výkonem, obnovení léčby je možné v době, kdy je dosaženo adekvátní hemostázy. Na zvážení je přemostění doby vysazení parenterálním antikoagulanciem.
Při akutním krvácení u pacientů léčených edoxabanem je nutné léčbu přerušit, lze podat aktivní uhlí. Symptomatická léčba je srovnatelná s ostatními xabany (chirurgické hemostázy, doplnění cirkulujícího objemu, koncentrát protrombinového komplexu, rekombinantní aktivovaný faktor VII) (34).
Možnosti omezení účinků NOAC
Jak již bylo řečeno výše, dnes zatím nejsou k dispozici specifická antidota NOAC, takže akutní krvácení jsou dle platných doporučení řešena vysazením NOAC vzhledem ke krátkému eliminačnímu poločasu používaných léčiv. Chirurgická hemostáza by měla být samozřejmostí ve všech případech krvácení, dále je doporučována nespecifická léčba ve formě protrombinázového komplexu, aktivovaného faktoru VII nebo čerstvé mražené plazmy. Zatím není s podáváním těchto přípravků v případě závažného krvácení dostatek klinických dat a navíc při nesprávném dávkování mohou působit excesivně protromboticky. Z těchto důvodů jsou zkoumány látky selektivně a bezpečně inhibující účinky NOAC.
V současné době je testováno několik přípravků v pokročilé fázi na lidských dobrovolnících s nadějnými výstupy. Nejnadějnější kandidáti na registraci a klinické použití jsou dvě dále popisované látky. První je andexanet alfa – biologicky neaktivní látka imitující faktor Xa, selektivně inhibující účinek přímých i nepřímých inhibitorů faktoru Xa. Druhý přípravek je idarucizumab – plně humanizovaný fragment protilátky (Fab), který je specifickým antidotem dabigatranu. Výsledky výzkumu obou látek byly prezentovány v roce 2013 – andexanet na American Society of Hematology (ASH) 55th Annual Meeting a Fab na American Heart Association (AHA) 2013 Scientific Sessions (22) a výzkum nadále intenzivně pokračuje. Poslední publikace z letošního listopadu zveřejňující výsledky studií ANNEXA-A (apixaban) a ANEXA-B (rivaroxaban) na starších zdravých dobrovolnících, při kterých byla testována účinnost a bezpečnost andexanetu, přinášejí slibné výsledky. Stejně jako při předchozích studiích na mladých zdravých dobrovolnících došlo k rapidnímu (2 – 5 minut) poklesu účinnosti obou antikoagulancií, nebyly zaznamenány žádné vážnější nežádoucí účinky a nebyla zaznamenána tvorba protilátek proti faktoru X a Xa. V další fázi studie ANNEXA-4 by andexanet měl být testován na pacientech se závažným krvácením užívajících inhibitor Xa (35).
Ještě dále je vývoj idarucizumabu, dne 24. 9. 2015 Výbor pro léčivé přípravky pro humánní použití European Medicines Agency doporučil vydání rozhodnutí o registraci léčiva PRA XBIND. Tento přípravek s účinnou látkou idarucizumab bude určen k rychlému zvrácení antikoagulačního efektu Pradaxy v případě život ohrožujícího nekontrolovatelného krvácení a urgentní chirurgie u pacientů léčených Pradaxou. Pra xbind bude k dispozici v dohledné době, jakmile Evropská komise schválí registraci léčiva, a bude velice pravděpodobně vázán pouze na nemocniční péči (36). Zkoumány jsou i další látky schopné inhibovat účinek NOAC.
Ošetřování pacientů s antikoagulační léčbou
Před invazivním chirurgickým ošetřením je zapotřebí se důkladně obeznámit s celkovým zdravotním stavem pacienta, typem užívaného antitrombotika a eventuálně dalšími užívanými léky potenciálně zvyšujícími riziko krvácení. Předpokladem úspěšného ošetření je adekvátní materiální vybavení ordinace a dostatečná erudice zdravotnického personálu.
Plánované výkony je vhodné provádět počátkem týdne ráno, samozřejmostí by mělo být jejich co nejšetrnější provedení (14, 35, 36, 37, 38, 39). V případě pacienta s antikoagulační léčbou bez dalších rizikových faktorů (tzn. pacienti léčení hepariny v běžném dávkování, kumariny v terapeutickém rozmezí – INR 2 – 3, NOAC v běžném dávkování bez přidružené alterace ledvinných funkcí či těžké hepatální insuficience) lze bez většího rizika provádět běžné stomatochirurgické výkony bez nutnosti předoperační přípravy (25, 35). U pacienta bez výše popsaných rizikových faktorů léčeného NOAC není třeba před stomatochirurgickým výkonem laboratorně ověřovat hemokoagulační parametry (na rozdíl od kumarinů, kde je dobré znát aktuální hodnotu INR z důvodu časté fluktuace hodnot). V případě standardně vedené léčby NOAC lze při výkonu očekávat krvácení srovnatelné s krvácením při léčbě kumariny v terapeutickém rozmezí, nebo i nižším, a to potvrzují i naše klinické zkušenosti.
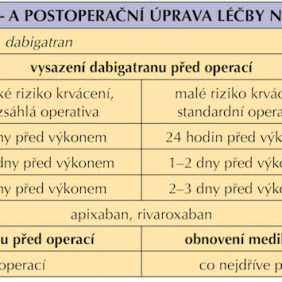
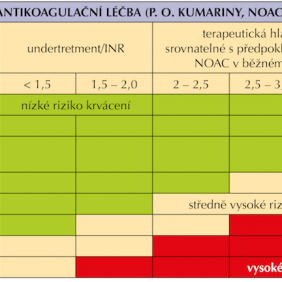
V případě rozsáhlejšího stomatochirurgického výkonu nebo přítomnosti rizikových faktorů, kdy lze očekávat větší krvácení, je vhodné spolupracovat s lékařem indikujícím antitrombotickou léčbu, či pacienta odeslat na specializované stomatochirurgické pracoviště (25). Podobné výkony mohou vyžadovat předoperační přípravu, která v případě NOAC znamená jejich dočasné vysazení, pravidla pro vysazování NOAC shrnuje tabulka (tab. I).
Spyropoulos rozlišuje riziko krvácení na vysoké – v případě výkonu trvajícího déle než 45 minut, maxilofaciální onkologické operativy a mnohočetných zubních extrakcí, a nízké – výkon do 45 minut, běžné zubní extrakce (37). Riziko krvácení u pacientů léčených NOAC je srovnatelné s rizikem u pacientů léčených kumariny v terapeutickém rozmezí, proto v přiložené upravené tabulce (tab. II) je přehledně zobrazeno spektrum výkonů s jejich riziky (10, 38).
Po výkonu se doporučuje ránu důkladně lokálně ošetřit, čímž se rozumí dostatečná sutura spolu s použitím lokálních hemostatik (želatina, kolagen, oxycelulóza, fibrinová a trombinová tkáňová lepidla apod.) (9, 17, 25, 39, 40, 41). Lokální ošetření rány lze doplnit i. m. nebo i. v. podáním 1 – 2 ampulí etamsylátu (DICYNONE). Po výkonu je vhodné pacienta poučit o pooperačním režimu – nevyplachovat ústa 24 hodin po výkonu, ledovat k zamezení otoku a rozvoje bolestí, analgezii lze doplnit medikamentózně, nejlépe léčivy neovlivňujícími trombocyty (ne analgetika s obsahem ibuprofenu, ketoprofenu, kyseliny acetylsalicylové apod.), po dobu trvání účinku anestezie nekonzumovat potravu, dále v prvních dnech konzumovat spíše chladnější kašovitou stravu. Pacienta lze vybavit sterilním obvazovým materiálem, který v případě krvácení použije ke kompresi rány např. do skusu na 15 minut. Vhodné je též jej informovat, kde nalezne pomoc v případě komplikací (kontakty na LSPP, stomatochirurga) (14, 33, 42, 43).
Příklad ošetření pacienta užívajícího NOAC
Jako příklad ošetření pacienta užívajícího NOAC uvádíme pacientku léčenou v březnu 2014 na naší klinice, která užívala rivaroxaban (XARELTO) v dávce 20 mg à 24 hodin. Z osobní anamnézy bylo známo, že trpí středně těžkou mentální retardací s poruchami chování, epilepsií, hepatopatií, obezitou, hyperlipidemií, eufunkční strumou a je sledována na nefrologii pro opakované infekce močových cest a pomočování. Pro poranění kotníku pravé dolní končetiny a vzhledem k přidruženým onemocněním byla zajištěna rivaroxabanem v rámci prevence tromboembolismu.
Farmakologická anamnéza obsahuje tyto údaje: Depakine 500 0 – 0 – 1,5, Tisercin 1 – 0 – 3, Citalec 20 1 – 0 – 0, Sorbifer 1 – 0 – 0, Xarelto 20 1 – 0 – 0. Chrup této mladé pacientky byl bohužel výrazně kariézně destruován a nedalo se předpokládat zlepšení úrovně ústní hygieny ani do budoucna.
Vzhledem k výše uvedeným onemocněním byla naplánována radikální sanace chrupu za hospitalizace v celkové anestezii. Předoperační laboratorní vyšetření potvrdilo normální jaterní funkce stejně jako i ostatní biochemické markery, žádné abnormality v krevním obrazu a pouze mírnou prolongaci aP TT v hemokoagulačních testech. Z tohoto důvodu a pro možnost observace a včasného zásahu v případě komplikací bylo rozhodnuto nevysazovat zavedenou antikoagulační léčbu.
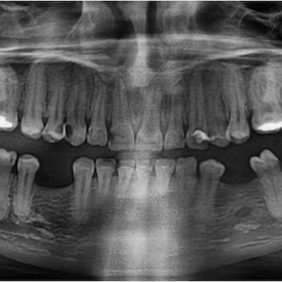
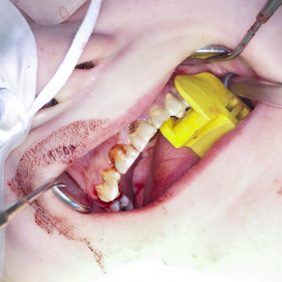
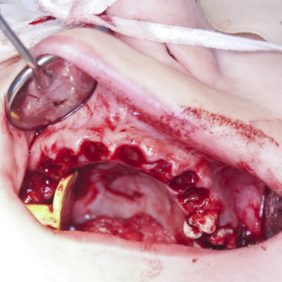
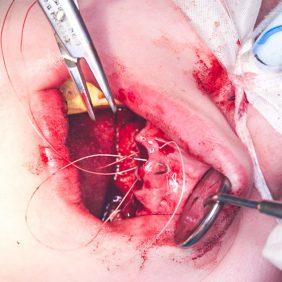
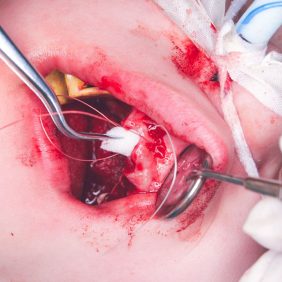
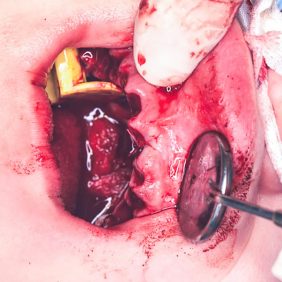
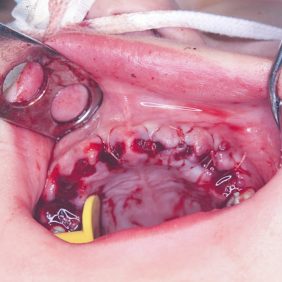
Po konzervativním ošetření méně poškozených zubů byla provedena chirurgická sanace v této podobě: jednoduché extrakce zubů 17, 14, 13, 12, 11, 21, 22, 23, 24, 27, dále chirurgické extrakce zubů 38, 37, 47 a 48. Extrakční lůžka byla důkladně zrevidována s odstraněním veškeré granulační tkáně a do lůžek se vložila želatinová pěna, všechny extrakční rány se zajistily pevnou resorbovatelnou suturou. Během výkonu ani v pooperačním období jsme nezaznamenali signifikantně zvýšené krvácení (obr. 1), (obr. 2), (obr. 3), (obr. 4), (obr. 5), (obr. 6), (obr. 7).
Závěr
Naprostá většina pacientů léčených NOAC nepředstavuje pro ošetřujícího stomatologa riziko vyplývající ze závažného krvácení v souvislosti s plným spektrem stomatochirurgických výkonů poskytovaných v privátní ambulantní sféře.
Zvýšené riziko tromboembolismu však vzniká při vysazení antikoagulancia, s následkem závažného, až život ohrožujícího stavu.
Při stomatochirurgickém ošetřování pacientů léčených NO AC je důležité seznámit se s jejich celkovým zdravotním stavem (zejména přítomnost onemocnění jater či ledvin), chronickou medikací z důvodu možných interakcí a případně současně užívanými analgetiky negativně ovlivňujícími činnost destiček (těmto léčivům se vyhýbáme i v pooperační fázi).
Na základě informací dostupných v odborné literatuře a vlastních klinických zkušeností doporučujeme NOAC u nízce rizikových výkonů nevysazovat, je však třeba dbát opatrnosti a správně zvážit míru rizika plynoucí z charakteru výkonu. Zatím bohužel nemáme žádné zkušenosti s ošetřováním pacientů léčených edoxabanem. Samozřejmostí je správné a šetrné provedení výkonu s důkladným lokálním ošetřením rány. U pacientů s vysokým rizikem tromboembolie a při plánovaném vysoce rizikovém výkonu spojeném s krvácením je vhodné spolupracovat s ošetřujícím internistou i specializovaným stomatochirurgickým pracovištěm.
Obrazová dokumentace
Literatura
1. Cífková R. Epidemiologie kardiovaskulárních onemocnění. Postgraduální medicína, příloha kardiologie, 2006, 8(5): 6 – 22.
2. Krčová V, Hluší A, Palová M, et al. Nová antikoagulancia – možnosti monitorování antikoagulačního účinku (dabigatran). Interní medicína pro praxi, 2012, 14(8 a 9): 318 – 322.
3. Wardrop D, Keeling D. The story of the discovery of heparin and warfarin. British Journal of Hematology, 2008, 141(6): 757–763.
4. Gray E, Mulloy B, Barrowcliffe TW. Heparin and low-molecular-weight heparin. Thrombosis and haemostasis, 2008, 99(5): 807 – 818.
5. Campbell HA, Roberts WL, Smith WK, et al. Studies on the hemorrhagic sweet clover disease I., the preparation of hemorrhagic concentrates. Journal of Biological Chemistry, 1940, 136: 47–55.
6. Campbell HA, Link KP. Studies on the hemorrhagic sweet clover disease IV., the isolation and crystallization of the hemorrhagic agent. Journal of Biological Chemistry, 1941, 138: 21–33.
7. Campbell HA, Smith WK, Roberts WL, et al. Studies on the hemorrhagic sweet clover disease II., the bioassay of hemorrhagic concentrates by following the prothrombin level in the plasma of rabbit blood. Journal of Biological Chemistry, 1941, 138: 1–20.
8. Stahmann MA, Huebner CF, Link KP. Studies on the hemorrhagic sweet clover disease V., identification and synthesis of the hemorrhagic agent. Journal of Biological Chemistry, 1941, 138: 513– 527.
9. Bulik O. Problematika stomatochirurgického ošetření v průběhu antikoagulační terapie, souborný referát, část I. Česká Stomatologie, 2003, 103(3): 102–106.
10. Ščigel V. Repetitorium klinické farmakologie I., antikoagulační a antiagregační léčba. LKS, 2003, 13(1): 10 – 15.
11. Shapiro SS. Treating thrombosis in the 21st century. The New England Journal of Medicine, 2003, 349(18): 1762 – 1764.
12. Malý J, Matýšková M, Penka M. Antikoagulační léčba, doporučený diagnostický a léčebný postup pro všeobecné praktické lékaře. 1. vydání, Společnost všeobecného lékařství ČLS JEP, Praha, 2005, 1 – 2.
13. Matýšková M. Warfarin, potrava a potravinové doplňky. Interní medicína pro praxi, 2010, 12(2): 87–91.
14. Houba R, Zemen J, Bartáková V. Rukověť zubního lékaře – pacient se zdravotním rizikem. 1. vydání, ČSK, Praha, 2012, 88 – 89.
15. Kessler P. Antikoagulační léčba warfarinem. Interní medicína pro praxi, 2005, 7(4): 182 – 185.
16. Krčová V, Hluší A, Palová M, et al. Nová antikoagulancia – možnosti monitorování antikoagulačního účinku (dabigatran). Interní medicína pro praxi, 2012, 14(8 a 9): 318–321.
17. Bulik O. Extrakce zubů a antikoagulační terapie – srovnání různých postupů. Praktické zubní lékařství, 2004, 52(3): 68–77.
18. Gray E, Mulloy B, Barrowcliffe TW. Heparin and low-molecular-weight heparin. Thrombosis and Haemostasis, 2008, 99(5): 807 – 818.
19. Boehringer Ingelheim Canada Ltd. Pradaxa product monograph, Burlington, 2014, http://www.boehringer-ingelheim.ca/en/news/press_releases/2014/4September201411.html
20. Karetová D. Nová éra perorální antikoagulační léčby. Lékařské listy, Angiologie, 2012, 20(4): 9 – 14.
21. Kvasnička T. Nová antikoagulancia a jejich současné indikace. Medicína pro praxi, 2012, 9(5):230 – 232.
22. Hughes S. Promising Data on Antidotes to New Anticoagulants, Medscape medical news, Neurology, 2013, http://www.medscape.com/viewarticle/818169
23. Karetová D, Bultas J. Nová antikoagulancia v léčbě kardiovaskulárních chorob. Interní medicína pro praxi, 2009, 11(6): 263–266.
24. Massicotte A. A practice tool for the new oral anticoagulants. Canadian pharmaceutical journal, 2014, 147(1): 25–32.
25. Ballantyne S. Guideline for managing patients on Rivaroxaban (Xarelto®), 2013, http://www.health.qld.gov.au/qhcss/mapsu/documents/dabigatran_info.pdf
26. Garcia D, Barrett YC, Ramacciotti E, et al. Laboratory assessment of the anticoagulant effects of the next generation of oral anticoagulants. Journal of thrombosis and haemostasis, 2013, 11(2): 245–52.
27. European medical assotiation, product informations, http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/000944/WC500057108.pdf
28. Bayer Inc., Xarelto product monograph, Toronto, 2013, http://www.bayer.ca/files/XARELTO-PM-ENG-10JUL2014 – 172618.pdf
29. Agnelli G, Gallus A, Goldhaber SZ, et al. Treatment of proximal deep-vein thrombosis with the oral direct factor Xa inhibitor rivaroxaban (BAY 59 – 7939). Circulation, 2007, 116(6): 180–187.
30. Urbánek K, Gallo J. Rivaroxaban v prevenci tromboembolizmu po velkých ortopedických operacích. Praktické lékárenství, 2009, 5(6): 263 – 265.
31. Assche KV. BIOPHEN® DiXaI – For the Quantitative Determination of Direct Factor Xa Inhibitors inPlasma, Bayer – Belgium, February 2012, http://www.aniara.com/pdf/SS-ANIARA-Biophen-DiXaI-vs-1 – 4.pdf
32. Eliquis product monograph, Kirkland, Pfizer Canada Inc, 2014, http://www.pfizer.ca/en/our_products/products/monograph/313
33. Siebert T. Stomatologické výkony u pacientů na antitrombotické léčbě. Stoma Team, 2010, 10(5): 25 – 29.
34. Lixiana: EPAR – Product information. European Medicines Agency, 18. 11. 2015, www.ema.europa. eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/002629/WC500189045.pdf
35. Siegal DM, Cornutte JT, Connolly SJ, et al. Andexanet Alfa for the reversal of factor Xa inhibitor activity. The New England Journal of Medicine, 2015, DOI: 10.1056/NEJMoa1510991.
36. Committee for medicinal products for human use summary of positive opinion for Praxbind. European Medicines Agency, 2015, UK, London.
37. Mingaro-de-Leon A, Chaveli-Lopez B. Alternative to oral dicoumarin anticoagulants: Consideration in dental care. Journal of clinical and experimental dentistry, 2013, 5(5): 273 – 278.
38. Fakhri HR, Janket SJ, Jackson EA, et al. Tutorial in oral antithrombotic therapy: Biology and dental implications. Medicina oral, patologia oral y cirurgia bucal, 2013, 18(3): 461 – 472.
39. Spyropoulos AC, Douketis JD. How I treat anticoagulated patients undergoing an elective procedure or surgery. Blood, 2012, 120(15): 2954 – 2962.
40. Ščigel V. Repetitorium klinické farmakologie pro praxi zubního lékaře. 2. vydání, ČSK, Praha, 2010, 32.
41. Houba R, Zemen J. Hlavní zásady ošetřování rizikových pacientů ve stomatologické ordinaci. Progresdent, 1998, 3(5): 16–22.
42. Vaněk J, Semrád B. Kardiovaskulární rizika ve stomatologické chirurgii a jejich prevence. In: Kilian J et al. Prevence v stomatologii. 1. vydání, Praha, 1999, 192.
43. Zemen J, Houba R, Krňoulová J. Problematika stomatochirurgického ošetřování pacientů s perorální antikoagulační terapií – aktuální přehled. LKS, 2002, 12(2): 9 – 11.
44. Altman R. New oral anticoagulants: are coagulation units still required? Thrombosis Journal, 2014, 12(3): 267 – 269.
14. 12. 2015
Print: LKS. 2015; 25(12): 244 – 251
Autoři:
Fotografie
- Archiv autorů
Rubrika:
Téma: