Dentální implantáty v kostních mikrovaskulárních lalocích
Přehledový článek
Souhrn: Článek poskytuje základní informace o možnostech zavedení dentálních implantátů do mikrovaskulárních kostních laloků. Mikrovaskulární kostní laloky jsou nyní zlatým standardem pro léčbu nejen onkologických pacientů s malignitami v oblasti hlavy a krku, ale také u pacientů s pokročilou osteonekrózou nebo posttraumatickými defekty maxily a mandibuly. Univerzální metoda používaná pro rekonstrukci horní nebo dolní čelisti je rekonstrukce fibulárním lalokem, který je dnes jedním z nejčastěji používaných mikrovaskulárních laloků. Rehabilitace onkologických pacientů s pomocí konvenčních celkových nebo částečných snímatelných náhrad je obtížná nebo nemožná, i když je rekonstrukce čelisti pomocí laloku ideální. Zavedení dentálních implantátů do mikrovaskulárního laloku komplikuje široká škála faktorů od změněných anatomických poměrů v dutině ústní, snížené nebo zvýšené výšky kosti laloku – neoalveolu oproti mandibule nebo maxile, nebo omezeného otevírání úst. V neposlední řadě musíme brát v úvahu časové hledisko pro eventuální radioterapii. Velká pozornost je věnovaná i obnově objemu a kvality měkkých tkání nově vytvořené čelisti. V přehledu jsme dále shrnuli poznatky o časových faktorech důležitých pro implantaci, způsobu implantace i komplikacích. Na konci článku jsme se zaměřili na doporučení pro praktické zubní lékaře, pokud v praxi ošetřují pacienta s volným lalokem rekonstruovaným dentálními implantáty.
Klíčová slova: dentální implantát, mikrovaskulární lalok, rekonstrukce
Dental implants in bone microvascular flaps
Review article
Summary: The article provides basic information about the possibilities of jaw reconstruction with microvascular bone flaps and dental implants. Microvascular bone flaps remain the gold standard for the treatment of not only oncological patients with malignancy of the head and neck, but also of patients with advanced osteonecrosis or post-traumatic defects of maxilla or mandible. The universal method used for the reconstruction of the upper or lower jaw is a free fibular flap, which is today one of the most commonly used microvascular flap. Rehabilitation of oncological patients with the help of complete or partial removable dentures is difficult or impossible, although the reconstruction of the jaw with the flap is ideal. Insertion of dental implants into the microvascular flap is complicated by a wide range of factors ranging from altered anatomical conditions in the oral cavity, reduced height of the fibular flap compared to the mandible or maxilla or limited mouth opening. Last but not least, time factor for eventual radiotherapy has to be considered. In the review, we have further summarized the knowledge of time factors important for implantation, the method of dental implant placement and complications. Special attention has been paid to the renewal of the volume and quality of the soft tissues. At the end of the article, we focused on recommendations for general dentists in practice, who treat and follow patients with a free osseous flap with dental implants.
Key words: dental implant, microvascular flap, reconstruction
Úvod
Kostní defekty v orofaciální oblasti nejčastěji vznikají z důvodu traumat, cyst, benigních nebo maligních nádorů, pseudoartrózy, osteomyelitidy nebo atrofie [1, 2, 3, 4]. Jednou z největších skupin pacientů, které spadají do oboru maxilofaciální chirurgie, je skupina onkologických pacientů. Nádory v oblasti hlavy a krku mají multimodální způsob léčby – využívá se kombinace více přístupů od chirurgické resekce, radioterapie, chemoterapie až po možnosti biologické léčby. Na rozdíl od jiných oborů je chirurgie hlavy a krku náročná z pohledu postresekčního výsledku, kdy je třeba resekovaný defekt následně uzavřít, což je ve většině případů technicky náročné pro nedostatek zbylých tkání. V dnešní době je rekonstrukce velkých defektů v maxilofaciální oblasti volnými autologními transplantacemi tkání – mikrovaskulárními laloky vnímána jako zlatý standard se zavedenými protokoly [5].
Posouzení lokálních podmínek, rizik a možných komplikací poskytuje důležité informace pro volbu typu, složení a způsobu transplantace laloku. V případě rekonstrukce segmentových defektů čelistí se vaskularizované volné laloky ukazují jako nesmírně užitečné, protože i velké a nedostatečně prokrvené oblasti mohou být chirurgicky úspěšně obnoveny [1, 2, 3, 4]. V případě, že dochází k resekci nejen měkkých, ale i tvrdých kostních tkání, je třeba nahradit i kost – nejčastěji se k tomuto účelu používá fibulární lalok, lalok odebraný z lopaty kosti kyčelní (crista iliaca), v anglosaské literatuře uváděný jako DCIA (angl. deep circumflex iliac artery bone flap), nebo v případě rozsáhlých defektů horní čelisti případně lalok z lopatky (scapula).
Obecně platí, že po ukončení onkologické terapie a remise onemocnění klesá kvalita pacientova života, a to i v případě, že je pacient po rekonstrukci mikrovaskulárním lalokem. Tato skupina pacientů má problémy v každodenním životě a ve většině případů úplnou nebo částečnou ztrátu chrupu. Rekonstrukce chrupu takto ošetřených pacientů s pomocí konvenčních totálních nebo částečných snímatelných náhrad může být obtížná nebo nemožná, i když je rekonstrukce dolní nebo horní čelisti ideální [6]. Rekonstrukce kontinuity čelistí a jejího krytí měkkými tkáněmi má zásadní význam pro dlouhodobý úspěch. Pokud v důsledku resekce nádoru nezůstal žádný zbytkový chrup vhodný pro retenci zubní protézy, protetická rekonstrukce s dentálním, dentomukózním či mukózním přenosem žvýkacího tlaku se ukazuje jako prakticky nemožná. Pacienti ztrácejí možnost přijímat stravu v tuhé formě, nemají možnost mastikace ani správné artikulace, což v kombinaci s dalšími následky onkologického onemocnění výrazně zhoršuje kvalitu jejich života. Defekty v oblasti hlavy a krku ohrožují jednotlivce v psychosociální oblasti, a v krajních případech mohou vést i k sociální izolaci či suicidálním tendencím. Rozhodující pro úspěch rekonstrukčních výkonů je proto i sociální přijetí pacienta, estetický a funkční výsledek chirurgické, případně i protetické rehabilitace [8]. Nejběžnějším způsobem rehabilitace u těchto pacientů je zavedení dentálních implantátů do kosti mikrovaskulárních laloků (terminologicky neomaxilla nebo neomandibula) a následné laboratorní zhotovení hybridních nebo podmíněně snímatelných náhrad nesených implantáty. V mezinárodním kontextu je tento způsob ošetření pacientů dnes již standardem.
Mikrovaskulární kostní laloky
Vaskularizované laloky mohou být volné nebo stopkaté, které zůstávají připojené na vyživujících cévách („pedikl“) a následně jsou mobilizované a umožňují jeho přenos. Biologická výhoda vlastního krevního zásobení spočívá v plnohodnotné výživě tkání, ve vyšší odolnosti vůči infekci a podpoře hojení [9, 3]. Nejvhodnější způsob rekonstrukce volíme v závislosti na rozsahu a lokalitě defektu.
Dolní čelist (mandibula) podmiňuje konturu dolní etáže obličeje a je nezbytná pro mnoho složitých funkcí zahrnujících dutinu ústní a hypofarynx [10]. V případě, že je defekt vyžadující rekonstrukci lokalizován v rámci dolní čelisti, je primární volbou pro rekonstrukci nejčastěji fibulární lalok, eventuálně DCIA lalok. Skapulární lalok je určen pro rekonstrukce maxily a středně velkého defektu střední obličejové etáže [11]. V praxi lze také použít lalok DCIA pro rekonstrukci horní čelisti, což je však komplikované krátkou cévní stopkou.
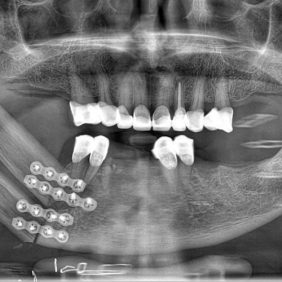
Z různých možných laloků má lalok fibulární mnoho výhod, a proto může být považován za první volbu léčby [12]. Rekonstrukce mandibuly pomocí mikrovaskulárního fibulárního laloku je nejčastějším řešením pro obnovení anatomického oblouku corpus mandibulae, čímž je možné obnovit funkce orofaciální oblasti a estetiky obličeje. Jeho odběr je relativně jednoduchý a dva chirurgické týmy mohou pracovat současně – v jedné chvíli tak probíhá resekce nádoru i odběr laloku, následně ve stejné době probíhá uzávěr rány dolní končetiny a rekonstrukce defektu orofaciální oblasti. Tím je celkový čas chirurgického výkonu výrazně redukován, což je u pacienta v celkové anestezii jeden z velmi významných faktorů, neboť klesá celková farmakologická zátěž, krevní ztráta i potenciální rizika spojená s dlouhodobějším výkonem. Délka odebrané kosti může při celkové rekonstrukci dolní čelisti dosáhnout 25 až 27 cm [13, 14, 15]. Nevýhodou, kterou je třeba zmínit, je omezená vertikální výška štěpu fibulárního laloku. Vertikální diskrepance mezi segmentem laloku a okluzní rovinou může být vyřešena několika způsoby – kostním štěpem, distrakcí fibulárního laloku nebo tzv. double barrel technikou [16]. Double barrel (dvojvrstvý) fibulární lalok (obr. 1) kompenzuje víceméně úplně vertikální mezeru mezi fibulárními a alveolárními hřebeny [17, 18]. Lin et al. navrhli techniku pro rekonstrukci čelisti pomocí vaskularizovaného fibulárního segmentu k rekonstrukci alveolární části neomandibuly, přičemž části nevaskularizované reziduální fibuly byly použity k simulaci dolní bazální části [16].
Fibulární mikrovaskulární lalok s vysokým obsahem kortikální kosti je stabilní vzhledem k vysoké tvrdosti kortikální kosti. Kortikální kost má navíc vysoký obsah kostních morfogenetických proteinů (angl. bone morphogenic proteins; BMPs), které působí aktivně osteoinduktivně a tím podporují proces hojení kostí [19]. V případě rekonstrukce chrupu u pacienta s neomandibulou z transplantovaného fibulárního laloku, je stabilita snímatelné náhrady komplikována hlavně tloušťkou kožní a podkožní tkáně [20], současně často ztrátou původního anatomického tvaru vestibula.
Důležité faktory u pacientů před implantací do mikrovaskulárního laloku
Dentální implantáty by měly být do kosti mikrovaskulárního laloku zaváděny u pacientů, kteří jsou ochotni a dlouhodobě schopni udržovat pečlivou ústní hygienu, podstoupit všechny chirurgické a protetické fáze, přesně dodržovat všechny pokyny dispenzární péče. Je třeba zmínit, že ne všichni pacienti jsou pro takovou míru spolupráce dostatečně motivováni – musíme si uvědomit, že řada pacientů s maligními nádory orofaciální oblasti jsou etylici, silní kuřáci, anebo obojí [21]. Zavedení dentálních implantátů se týká zejména pacientů s nízkým rizikem recidivy základního onkologického onemocnění a dostatečným časovým odstupem od radioterapie. Nedostatečné otevření úst, onemocnění závěsného aparátu, zubní kaz a jiné intraorální stavy by měly být řešeny před samotnou onkologickou terapií, nebo nejpozději při zvážení implantace. Důležité je vyšetřit pohyblivost jazyka, přítomnost nebo absenci dostatečně hlubokého vestibula (fornix vestibuli superior et inferior), retní uzávěr a orální funkce [22].
Před implantací je nezbytné prozkoumat, zda jsou splněny požadavky na měkké tkáně a kosti přijatelné – pro úspěšnou implantaci musí být vytvořeny a splněny určité podmínky [23]. Zdravá, dobře vaskularizovaná měkká tkáň musí překrývat kost, do které mají být implantáty zavedeny. Požadavky na kost jsou mnohem přísnější: minimální svislá výška kostí je 10 mm a minimální vodorovná šířka 3,75 mm [24]. Cévní stopku je vhodné umístit na kaudální stranu kostního laloku, aby bylo možné implantovat do bezpečné vzdálenosti od ní a nebyla ohrožena vitalita laloku [11].
V předoperační přípravě je také důležité zvážit odstranění osteosyntetických dlah, zejména v lokalizacích, do kterých plánujeme zavést dentální implantáty – podmínkou je samozřejmě dostatečná stabilita kostních fragmentů bez rizika jejich dislokace.
Časové faktory implantace do mikrovaskulárního laloku po rekonstrukci čelisti
Vzhledem k relativní heterogenitě léčby, podmíněné různými stadii a invazivitou nádoru a současně odlišnou odpovědí pacientů na léčbu, neexistuje jednoznačný časový protokol ohledně provedení mikrovaskulárního laloku a zavedení implantátů. Zavedení implantátů proto indikujeme vždy přísně individuálně, nejčastěji v rozmezí od 4 do 12 měsíců po přenosu laloku [25, 26]. V závislosti na řadě faktorů je možné začít druhou fázi v období mezi 3 a 6 měsíci po implantaci, v souladu s Brånemarkovým protokolem [27, 28].
Urken et al. [29] jako první navrhli implantaci současně s rekonstrukcí pomocí mikrovaskulárního laloku. Tento postup preferují i Sclaroff et al. [30], kteří ho ale modifikovali a navrhli jednofázový rekonstrukční postup se štěpem a implantací provedenou ve stejnou dobu, následovanou šestiměsíční lhůtou pro hojení, umístěním abutmentů a po 4 týdnech hojení zhotovení protetické rekonstrukce. Bodard et al. [20] nedoporučují okamžitou implantaci, protože období ischemie, během kterého se zavádějí dentální implantáty a lalok současně není vyživován, může být značně prodloužen. Čímž se zvyšuje riziko selhání integrace a umístění implantátů se provádí bez předem plánovaného umístění.
De Santis et al. [31] navrhli naopak dvoufázový protokol s lalokem a implantací provedenou v různých fázích (s šestiměsíčním časovým odstupem). Také studie dle Zlotowa [32] doporučuje, aby před zavedením dentálního implantátu do mikrovaskulárního kostního laloku uplynulo 6 – 12 měsíců. Attia et al. [12] ve své skupině pacientů implantovali do fibulárních laloků 5 měsíců po rekonstrukci čelisti.
Způsoby zavádění dentálních implantátů do mikrovaskulárního laloku
Technika implantace do neomaxily nebo neomandibuly vytvořené z kostního mikrovaskulárního laloku je velmi podobná technice v nativní čelisti, ale zajištění přístupu ke kosti je nejtěžším krokem operace [10]. Umístění implantátu je zásadní, jelikož musí být plánováno jak s ohledem na nabídku nové kostěné tkáně, tak na možnost jeho následného využití v rámci protetické rekonstrukce. Ve 4 % případů, i přes adekvátní oseointegraci, nemohly být implantáty použity k protetické rekonstrukci kvůli jejich nevhodnému umístění v neoalveolu [33].
Primární stabilita implantátů závisí do značné míry na hustotě kostí: fibula má bikortikální strukturu s kortikální tloušťkou lepší než hřeben kosti kyčelní nebo lopatka. Dobré úspěšnosti lze dosáhnout bikortikálním zavedením implantátů, které zajišťuje dostatečně velký povrch kontaktu kosti a implantátu, protože centrální prostor kostní dřeně postrádá hustou kost. Oblast neoalveolárního výběžku, kde byly provedeny osteotomie, by měly být ponechány bez fixtur implantátu, protože se jedná o nejslabší část rekonstrukce [34]. Aby se zabránilo infekci, je nutné úplné uzavření implantačního místa. V této operační době je možné zvýšit pohyblivost dolních rtů nebo tváří. Nejčastěji se používá prohloubení vestibula a obnova připojené gingivy s použitím epitelových, nebo pojivových štepů [35].
Následná protetická rehabilitace
Pokud kolem implantátu chybí keratinizovaná gingiva, je vhodná úprava měkkých tkání. Metodou volby je vestibuloplastika v kombinaci s umístěním epitelového štěpu, kterou je možné spojit se zavedením vhojovacích válečků [36].
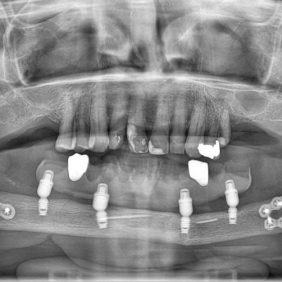
Opakovaně zmiňovaným problémem v literatuře je, že protetickou náhradu nebylo možné postavit kvůli nedostatečnému vestibulárnímu sklonu nebo byla její střednědobá stabilita narušena nadměrnými šikmými okluzními silami spojenými s lokálním podrážděním tkáně. Dle Iizuka et al. bylo možno využít pouze 62 % oseointegrovaných implantátů ve fibulárním laloku [33]. V literatuře se uvádí, že u menších kostních defektů je vhodnější použít fixní protetickou práci nesenou dentálními implantáty, a naopak v případě větších defektů, jako jsou resekce v rozsahu celého corpus mandibulae, se preferuje snímatelná protetická práce nesená dentálními implantáty, tj. hybridní náhrada. Pro optimální ústní hygienu se dává přednost právě hybridním náhradám [12] (obr. 2).
Úspěšnost
Attia et al. [12] uvádějí, že typ nádoru má zásadní vliv na úspěšnost implantátu. Pouze jeden pacient s benigním nádorem měl jedinou ztrátu implantátu.
V některých studiích ze všech implantátů pak 93 vykazovalo 1 mm kostní resorpce; 11 implantátů vykazovalo resorpci 1–2 mm a 14 implantátů vykazovalo resorpci 3 mm [12]. Wu a kol. [37] zjistili, že z 91 implantátů byl u 64 pozorován úbytek kostní hmoty 1 mm, u 25 implantátů úbytek 1–2 mm a u dvou implantátů byl úbytek větší než 3 mm. Gbara a kol. [38] uvádějí, že resorpce kosti byla menší než 1 mm u 62 implantátů, v rozmezí 1–2 mm u 35 implantátů a větší než 3 mm u 20 implantátů.
Kramer a kol. [39] uvedli, že úspěšnost 51 implantátů byla 96,1 % po průměrném období pozorování dvou let od implantace. Jacobsen a kol. [40] uvádějí míru přežití 1 a 5 let na 94 % a 83 % u 23 pacientů ošetřených 140 implantáty; míra přežití byla 86 %, když byla použita neozářená fibulární kost. Využití kratších délek implantátu nemělo vliv na míru selhání [32, 41]. Nedodržení bikortikálního zavedení implantátu bylo důležitou příčinou selhání u 50 % ztracených implantátů [20].
Komplikace
Nejnepříjemnějším stavem, se kterým se můžeme u těchto pacientů setkat, je recidiva základního onkologického onemocnění. Rekonstrukce defektů v orofaciální oblasti pomocí mikrovaskulárních laloků nám umožňuje v první fázi chirurgického výkonu – resekci nádoru – být maximálně radikální, čímž se snažíme o eliminaci rizika recidivy onkologického onemocnění. Neodmyslitelnou součástí správné léčby je však dispenzarizace onkologického pacienta po ukončení chirurgické či onkologické léčby ve smyslu radio- či chemoterapie. Měla by probíhat na erudovaných pracovištích maxilofaciální chirurgie.
Velká část pacientů jsou chroničtí kuřáci, u nichž je nutné se snažit o úplné odstranění, nebo pokud možno alespoň výrazné omezení tohoto zlozvyku a dodržování správné hygieny dutiny ústní. V případě nespolupráce pacienta hrozí ve studiích velmi často zmiňovaná periimplantátová mukositida, následovaná periimplantitidou a ztrátou implantátů.
Péče o pacienty v ordinaci praktického zubního lékaře
Závěrem bychom rádi připomněli několik doporučení, která jsou z praktického hlediska důležitá pro zubní lékaře v případě, že se setkají s pacientem, jehož čelist je rekonstruována pomocí mikrovaskulárního laloku.
V případě pacienta s onkologickým onemocněním v oblasti hlavy a krku je nutné dbát při stomatologickém ošetření především na exploraci (aspekci) dutiny ústní a vyloučení eventuálních podezřelých lézí ve smyslu recidivy základního onkologického onemocnění. V rámci následných kontrol (angl. recall) se pacienta neopomeneme zeptat na úbytek na váze v posledním období či na noční pocení. Nutností u této skupiny pacientů je pravidelná palpace lymfatických uzlin hlavy a krku. Pacient by měl být na ošetřujícím pracovišti maxilofaciální chirurgie dispenzarizován nejméně pět let po léčbě (ať už chirurgické nebo onkologické), preventivní prohlídky u praktického zubního lékaře by měly probíhat jednou za půl roku, v případě potřeby častěji.
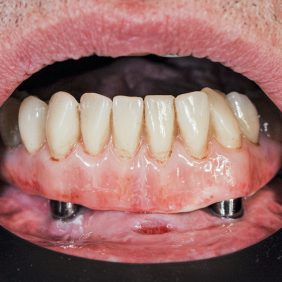
Zvláštní pozornost je třeba věnovat pacientům s onkologickým onemocněním v oblasti hlavy a krku, kteří podstoupili radioterapii. U této skupiny pacientů je třeba dbát na antibiotické krytí při extrakcích, prevenci proti vzniku osteoradionekrózy při chirurgických výkonech v dutině ústní i nutné antibiotické krytí [42]. Obecně je vhodné, aby stomatochirurgické výkony u těchto pacientů probíhaly na pracovištích maxilofaciální chirurgie. Nezbytná je důsledná klinická a radiologická kontrola neoalveolu čelisti, pravidelné hodnocení stability kosti a měkkých tkání okolí implantátu. Preferovány jsou podmíněné snímatelné nebo snímatelné protetické náhrady, které umožní pravidelnou dentální hygienu protetické práce, ale i protetických pilířů, kterými jsou zavedeny dentální implantáty (obr. 3).
Závěr
Nejen mikrovaskulární laloky, ale i rehabilitace onkologických pacientů po rekonstrukcích čelistí pomocí protetických náhrad nesených dentálními implantáty by měla být dnes standardem léčby maxilofaciální chirurgie. Na základě těchto poznatků se budou zubní lékaři stále více setkávat ve svých ambulancích s tímto typem pacientů, a proto by měli ovládat základní poznatky z této problematiky.
Poděkování: Věnováno všem našim mentorům
Finanční zdroje: Studie vznikla za podpory grantu IGA_LF_2021_008.
Obrazová dokumentace
Literatura
1. Shaffer JW, Field GA, Goldberg VM, Davy DT. Fate of vascularized and nonvascularized autografts. Clin Orthop Relat Res. 1985; Jul-Aug(197): 32 – 43.
2. Schmelzle R, Brosch T, Ahlemann CM. Mikrovaskularchirurgie im bestrahlten Gebiet. Tierexperimentelle Ergebnisse und klinische Relevanz [Microvascular surgery in irradiated areas. Experimental animal results and clinical relevance]. Dtsch Z Mund Kiefer Gesichtschir. 1986; 10(3): 166 – 169.
3. Disa JJ, Hidalgo DA, Cordeiro PG, Winters RM, Thaler H. Evaluation of bone height in osseous free flap mandible reconstruction: an indirect measure of bone mass. Plast Reconstr Surg. 1999; 103(5): 1371 – 1377.
4. Pogrel MA, Podlesh S, Anthony JP, Alexander J. A comparison of vascularized and nonvascularized bone grafts for reconstruction of mandibular continuity defects. J Oral Maxillofac Surg. 1997; 55(11): 1200 – 1206.
5. Wong CH, Wei FC. Microsurgical free flap in head and neck reconstruction. Head Neck. 2010; 32(9): 1236 – 1245.
6. Barber HD, Seckinger RJ, Hayden RE, Weinstein GS. Evaluation of osseointegration of endosseous implants in radiated, vascularized fibula flaps to the mandible: a pilot study. J Oral Maxillofac Surg. 1995; 53(6): 640 – 644; discussion 644 – 645.
7. Gbara A, Darwich K, Li L, Schmelzle R, Blake F. Long-term results of jaw reconstruction with microsurgical fibula grafts and dental implants. J Oral Maxillofac Surg. 2007; 65(5): 1005 – 1009.
8. Gbara A, Vesper M, Gehrke G, et al: Titanmagnetics als Hilfsmittel zur Verankerung bei anatomisch schwieriger Situation im Oberkiefer. Z Zahnärztl Implantol. 1995, 11: 196.
9. Ueba Y, Fujikawa S. Nine year follow-up of a vascularized fibula graft in neurofibromatosis: A case report and literature review. Orthop Trauma Surg. 1983; 26: 595 – 605.
10. Anne-Gaëlle B, Samuel S, Julie B, Renaud L, Pierre B. Dental implant placement after mandibular reconstruction by microvascular free fibula flap: current knowledge and remaining questions. Oral Oncol. 2011; 47(12): 1099 – 1104.
11. Turk JB, Vuillemin T, Raveh J. Revascularized bone grafts for craniofacial reconstruction. Otolaryngol Clin North Am. 1994; 27(5): 955 – 982.
12. Attia S, Wiltfang J, Pons-Kühnemann J, Wilbrand JF, Streckbein P, Kähling C, Howaldt HP, Schaaf H. Survival of dental implants placed in vascularised fibula free flaps after jaw reconstruction. J Craniomaxillofac Surg. 2018; 46(8): 1205 – 1210. doi: 10.1016/j.jcms.2018.05.008. Epub 2018 Jun 5.
13. Hidalgo DA, Pusic AL. Free-flap mandibular reconstruction: a 10-year follow-up study. Plast Reconstr Surg. 2002; 110(2): 438 – 449; discussion 450 – 451.
14. Urken ML, Buchbinder D, Costantino PD, Sinha U, Okay D, Lawson W, Biller HF. Oromandibular reconstruction using microvascular composite flaps: report of 210 cases. Arch Otolaryngol Head Neck Surg. 1998; 124(1): 46 – 55.
15. Laure B, Van Hove A, Aboumoussa J, Gendre C, Goga D. Le lambeau libre de péroné. Anatomie. Technique de prélèvement [The fibular free flap. Anatomy and technique for removal]. Rev Stomatol Chir Maxillofac. 2000; 101(3): 147 – 153.
16. Lin B, Yang H, Yang H, Shen S. Vascularized combined with nonvascularized fibula flap for mandibular reconstruction: preliminary results of a novel technique. J Craniofac Surg. 2019; 30(4): e365-e369.
17. Ruhin B, Menard P, Ceccaldi J, Dichamp J, Bertrand JC. Lambeau libre de péroné en double barre: intérêt du montage dans les reconstructions mandibulaires pour une réhabilitation prothétique sur implants (5 cas). Rev Stomatol Chir Maxillofac. 2006; 107: 338–344, discussion 345–346.
18. Bähr W, Stoll P, Wächter R. Use of the „double barrel“ free vascularized fibula in mandibular reconstruction. J Oral Maxillofac Surg. 1998; 56(1): 38 – 44.
19. Urist MR, McLean FC. Osteogenetic potency and new-bone formation by induction in transplants to the anterior chamber of the eye. J Bone Joint Surg Am. 1952; 34-A(2): 443 – 476.
20. Bodard AG, Bémer J, Gourmet R, Lucas R, Coroller J, Salino S, Breton P. Dental implants and free fibula flap: 23 patients. Rev Stomatol Chir Maxillofac. 2011; 112(2): e1 – 4. doi: 10.1016/j.stomax.2011.01.008. Epub 2011 Mar 2
21. Mazánek J. Orofaciální onkologie. První vydání. Praha: Triton; 2018.
22. Weischer T, Mohr C. Ten-year experience in oral implant rehabilitation of cancer patients: treatment concept and proposed criteria for success. Int J Oral Maxillofac Impl. 1999; 14(4): 521–528.
23. Šimůnek A a kol. Dentální implantologie. Třetí vydání. Hradec Králové: Artilis; 2017.
24. Frodel JL Jr, Funk GF, Capper DT, Fridrich KL, Blumer JR, Haller JR, Hoffman HT. Osseointegrated implants: a comparative study of bone thickness in four vascularized bone flaps. Plast Reconstr Surg. 1993; 92(3): 449 – 455, discussion 456 – 458.
25. Chiapasco M, Abati S, Ramundo G, Rossi A, Romeo E, Vogel G. Behaviour of implants in bone grafts or free flaps after tumor resection. Clin Oral Implants Res. 2000; 11: 66–75.
26. Taylor TD, Worthington P. Osteointegrated implant rehabilitation of the previously irradiated mandible: results of a limited trial at 3 to 7 years. J Prosthet Dent. 1993; 69: 60–69.
27. Hundepool AC, Dumans AG, Hofer SO, Fokkens NJ, Rayat SS, van der Meij EH, Schepman KP. Rehabilitation after mandibular reconstruction with fibula free-flap: clinical outcome and quality of life assessment. Int J Oral Maxillofac Surg. 2008; 37(11): 1009 – 1013.
28. Gürlek A, Miller MJ, Jacob RF, Lively JA, Schusterman MA. Functional results of dental restoration with osseointegrated implants after mandible reconstruction. Plast Reconstr Surg. 1998; 101(3): 650 – 655, discussion 656 – 659.
29. Urken ML, Buchbinder D, Costantino PD, Sinha U, Okay D, Lawson W, Biller HF. Oromandibular reconstruction using microvascular composite flaps: report of 210 cases. Arch Otolaryngol Head Neck Surg. 1998; 124(1): 46 – 55.
30. Sclaroff A, Haughey B, Gay WD, Paniello R. Immediate mandibular reconstruction and placement of dental implants. At the time of ablative surgery. Oral Surg Oral Med Oral Pathol. 1994; 78(6): 711 – 717.
31. De Santis G, Nocini PF, Chiarini L, Bedogni A. Functional rehabilitation of the atrophic mandible and maxilla with fibula flaps and implant-supported prosthesis. Plast Reconstr Surg. 2004; 113(1): 88 – 98, discussion 99 – 100.
32. Zlotolow IM, Huryn JM, Piro JD, Lenchewski E, Hidalgo DA. Osseointegrated implants and functional prosthetic rehabilitation in microvascular fibula free flap reconstructed mandibles. Am J Surg. 1992; 164(6): 677 – 681.
33. Iizuka T, Häfliger J, Seto I, Rahal A, Mericske-Stern R, Smolka K. Oral rehabilitation after mandibular reconstruction using an osteocutaneous fibula free flap with endosseous implants. Factors affecting the functional outcome in patients with oral cancer. Clin Oral Implants Res. 2005; 16(1): 69 – 79.
34. De Santis G, Nocini PF, Chiarini L, Bedogni A. Functional rehabilitation of the atrophic mandible and maxilla with fibula flaps and implant-supported prosthesis. Plast Reconstr Surg. 2004; 113(1): 88 – 98, discussion 99 – 100.
35. Rohner D. Kieferkammatrophie. Das präformierte vaskularisierte Fibulatransplantat als alternative Behandlungsmethode bei ausgeprägter Kieferkammatrophie [Alveolar ridge atrophy. The free vascularized fibular flap as alternative treatment in severe alveolar atrophy]. Schweiz Monatsschr Zahnmed. 2006; 116(5): 529 – 539.
36. Wei FC, Santamaria E, Chang YM, Chen HC. Mandibular reconstruction with fibular osteoseptocutaneous free flap and simultaneous placement of osseointegrated dental implants. J Craniofac Surg. 1997; 8(6): 512 – 521.
37. Wu YQ, Huang W, Zhang ZY, Zhang ZY, Zhang CP, Sun J. Clinical outcome of dental implants placed in fibula-free flaps for orofacial reconstruction. Chin Med J (Engl). 2008; 121(19): 1861 – 1865.
38. Gbara A, Darwich K, Li L, Schmelzle R, Blake F. Long-term results of jaw reconstruction with microsurgical fibula grafts and dental implants. J Oral Maxillofac Surg. 2007; 65(5): 1005 – 1009.
39. Kramer FJ, Dempf R, Bremer B. Efficacy of dental implants placed into fibula-free flaps for orofacial reconstruction. Clin Oral Implants Res. 2005; 16(1): 80 – 88.
40. Jacobsen C, Kruse A, Lübbers HT, Zwahlen R, Studer S, Zemann W, Seifert B, Grätz KW. Is mandibular reconstruction using vascularized fibula flaps and dental implants a reasonable treatment? Clin Implant Dent Relat Res. 2014; 16(3): 419 – 428.
41. Shaw RJ, Sutton AF, Cawood JI, Howell RA, Lowe D, Brown JS, Rogers SN, Vaughan ED. Oral rehabilitation after treatment for head and neck malignancy. Head Neck. 2005; 27(6): 459 – 470. doi: 10.1002/hed.20176
42. Bartáková V, Houba R, Zemen J. Rukověť zubního lékaře. Ošetřování pacientů s komplikujícím zdravotním stavem. Praha: ČSK a Havlíček Brain Team; 2005.
17. 9. 2022
Print: LKS. 2022; 32(9): 148 – 154
Autoři:
Fotografie
- Archiv autorů
Rubrika:
Téma:

