Inovovaný izolační protokol pro kmenové buňky zubní dřeně – pilotní studie
Původní práce
Souhrn:
Úvod: Zubní dřeň představuje relativně snadno dostupný zdroj mezenchymových kmenových buněk. Kmenové buňky ze zubní dřeně (KBZD) byly poprvé izolovány v roce 2000 a od té doby jsou intenzivně studovány.
Cíl: Cílem studie bylo optimalizovat proces izolace KBZD, zejména zkrátit dobu, po kterou je zubní dřeň enzymaticky štěpena. U KBZD izolovaných novým postupem stanovit proliferační aktivitu, fenotyp, viabilitu a ověřit schopnost jejich diferenciace ve zralé buněčné typy – osteoblasty, chondroblasty a adipocyty.
Materiály a metodika: Extrahovali jsme celkem pět stálých zubů a izolovali pět buněčných linií, které jsme kultivovali v modifikovaném kultivačním médiu (α-MEM) pro adultní mezenchymové progenitorové buňky, obohaceném o 2 % fetálního bovinního séra, růstové faktory, antibiotika, antimykotika, a doplněném o Insulin-Transferrin-Sodium-Selenium supplement. Pro stanovení viability, počtu a velikosti buněk jsme použili přístroje Vi-Cell analyzer a Z2-Counter. Fenotypová analýza byla provedena pomocí průtokového cytometru Cell Lab Quanta. Pro diferenciaci v chondroblasty, osteoblasty a adipocyty jsme použili komerčně dostupná diferenciační média. Průkaz diferenciace jsme dokazovali imunohistochemicky (osteokalcin a kolagen typu II) a histologickým barvením (modrý Massonův trichrom, barvení dle Kossy a olejová červeň).
Výsledky: KBZD jsme kultivovali do 8. pasáže. Buňky dosáhly průměrně 47,8 ± 2,0 populačních zdvojení (angl. population doublings; PD). Průměrný čas potřebný pro zdvojení populace (angl. doubling time; DT), činil 39,2 ± 6,1 hodin. Po celou dobu kultivace byly buňky proliferačně aktivní. Průměrná viabilita v 2. pasáži byla 92,3 ± 1,5 % a v 8. pasáži 92,4 ± 1,4 %. Fenotypovou analýzou jsme prokázali vysokou expresi povrchových antigenů pro mezenchymové kmenové buňky (angl. cluster of differentiation; CD) CD13, CD29, CD44, CD90, pro tzv. „stromal associated“ znaky CD73, CD166, a naopak nízkou či nízce pozitivní expresi znaků CD31, CD34, CD45, typických pro endoteliální a hematopoetickou buněčnou řadu. KBZD se diferencovaly ve zralé buněčné typy, osteoblasty a chondroblasty. I přes proadipogenně silně působící médium buňky nediferencovaly v adipocyty.
Závěr: Podařilo se nám optimalizovat izolační protokol pro KBZD tím, že jsme zkrátili dobu, po kterou je zubní dřeň enzymaticky štěpena. KBZD izolované touto metodou prokazovaly po celou dobu kultivace vysoký proliferační a diferenciační potenciál. Nezpozorovali jsme žádné známky spontánní diferenciace či degenerace. Právě pro vysokou proliferační aktivitu, široký diferenciační potenciál a snadnou dostupnost představují KBZD budoucnost v regenerativní medicíně.
Klíčová slova: kmenové buňky zubní dřeně, izolace kmenových buněk, enzymatická izolace, trypsin, buněčná analýza
Improved isolation protocol for dental pulp stem cells
Original article
Summary:
Introduction: The dental pulp represents an easily accessible source of adult dental pulp stem cells (DPSCs). They were isolated for the first time in 2000 and since then many researchers have investigated and analysed their biological characteristics.
Aim: The purpose of this study was to optimize the isolation protocol for DPSCs, namely to shorten the time of enzymatic digestion of the dental pulp, and to cultivate isolated DPSCs using this new approach, investigate their proliferation, phenotype, cell viability and determine their ability to differentiate into mature cells, chondroblasts, osteoblasts, and adipocytes.
Materials and methods: Out of five extracted permanent teeth, we isolated five dental pulp stem cell lineages. They were cultivated in a modified cultivation media (α-MEM) for mesenchymal adult progenitor cells containing 2 % fetal bovine serum (FBS) and supplemented with growth factors, antibiotics, antimycotics and Insulin-Transferrin-Sodium-Selenium supplement (ITS). The cell viability, cell count and other properties were examined using a Vi-Cell analyzer and Z2-Counter. The phenotype analysis was performed using a flow cytometer Cell Lab Quanta. For differentiation in chondroblasts, osteoblasts and adipocytes, we used commercially available differentiation media. The evidence of differentiation was proved by the immunocytochemistry (osteocalcin and collagen type II) and histological staining (blue Masson's trichrome, von Koss stain and oil red).
Results: We were able to cultivate DPSCs over 47.8 ± 2.0 population doublings (PD). The average population doubling time (DT) was 39.2 ± 6.1 hours. The average cell viability was 92.3 ± 1.5 % in the second passage and 92.4 ± 1.4 % in the eighth passage. DPSCs showed high positivity for mesenchymal stem cell markers (cluster of differentiation; CD) CD29, CD44, CD90 and for stromal associated markers CD13, CD73, CD166 and negative expression or low positivity for hematopoietic markers CD34, CD45 and for CD31. DPSCs differentiated into osteoblasts and chondroblasts. Even after the exposition of the strong adipogenic medium they did not show any signs of differentiation into adipocytes.
Conclusion: We have successfully optimized the isolation protocol for DPSCs by shortening the time of enzymatic digestion of the dental pulp. DPSCs isolated using the new method demonstrated the high proliferation and differentiation potential throughout long-term cultivation. We did not observe any signs of spontaneous differentiation or cell degeneration. DPSCs seems to be the promising future for a regenerative and reparative medicine thanks to their remarkable high proliferative potential and ability to differentiate into many mature cell populations.
Key words: dental pulp stem cells, stem cell isolation, enzymatic digestion, trypsin, biological cell analysis
Úvod
Zubní dřeň představuje relativně snadno dostupný zdroj postnatálních mezenchymových kmenových buněk. Tím, že je izolována od okolních struktur tvrdými zubními tkáněmi, zachovává si specifické mikroprostředí, nazývané „niche“, které ovlivňuje vlastnosti uložených kmenových buněk izolovaných ze zubní dřeně (KBZD) [1, 2]. Oddělená zubní dřeň si uchovává stavbu typickou pro primitivní (embryonální) tkáně, KBZD by proto měly vykazovat některé vlastnosti podobné embryonálním kmenovým buňkám. KBZD jako postnatální kmenové buňky mají tu výhodu, že dárce nebo jeho zákonný zástupce může dát informovaný souhlas s jejich využitím. Nevznikají tak silné etické rozpory jako při využití embryonálních kmenových buněk, kdy je odběr spojen se zánikem embrya.
KBZD byly poprvé izolovány v roce 2000 [3] a jejich schopnost sebeobnovy, diferenciace ve zralé buněčné typy in vitro a vysoký proliferační potenciál byly poprvé popsány v roce 2002 [4]. Od té doby se jeví jako velmi slibný zdroj buněk pro regenerativní medicínu. Navíc díky ektomezenchymovému embryonálnímu původu mohou vykazovat vlastnosti obou zárodečných listů – mezodermu i ektodermu [5].
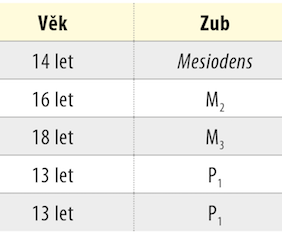
Extrakce zubu se provádí jako plánovaný výkon a zub spolu se zubní dření je považován za biologický odpad a je po extrakci likvidován. Využití těchto tkání pro izolaci KBZD tak pro pacienta nepředstavuje operační výkon navíc. Nejčastěji, v 77,6 % případů, jsou za těmito účely využívány třetí moláry [6], které jsou často extrahovány z důvodu retence či semiretence. Druhou nejčastější skupinou, využívanou v 10,7 % případů, jsou první premoláry [6], které jsou v indikovaných případech extrahovány z ortodontických důvodů okolo 12. roku věku. Jedná se tak často o intaktní zuby s nedokončeným vývojem kořene. Třetí nejčastěji využívané zuby jako zdroj KBZD jsou nadpočetné zuby, resp. mesiodenty, a to v 2,6 % [6].
V současné době existují dvě metody izolace KBZD. Prvním krokem, který je společný pro obě metody, je oddělení zubní dřeně od tvrdých zubních tkání extrahovaného zubu. K izolaci KBZD slouží buď metoda enzymatického štěpení (angl. enzymatic digestion, ED) [3, 7] nebo metoda spontánního vycestování z tkáně (angl. outgrowth, OG) [8, 9].
Při enzymatické izolaci se suspenze KBZD získává štěpením tkáně působením enzymů. Nejčastěji se jedná o směs kolagenázy typu I a dispázy v poměru koncentrací 1 : 1 [10, 11]. Doba působení enzymů je okolo 30 – 60 minut, různí se dle velikosti izolované tkáně. Výsledkem štěpení je suspenze jednotlivých buněk různého původu, zbytky cév a extracelulární matrix. KBZD poté adherují ke dnu kultivační nádoby a při výměně média se ostatní nečistoty odstraní. Doba působení enzymu je pro izolaci KBZD stěžejní, jelikož delší doba může negativně ovlivňovat viabilitu kmenových buněk [12].
Druhá technika je autory popisována jako metoda, kdy se rozmělněné části zubní dřeně vloží do kultivační nádoby s vhodným médiem a KBZD spontánně vycestovávají z tkáně a adherují k povrchu kultivační nádoby.
Ačkoliv je technika spontánního vycestování technicky méně náročná, všeobecně více využívaná metoda k izolaci mezenchymálních kmenových buněk je enzymatická izolace. KBZD získané touto metodou vykazují vyšší proliferační aktivitu, diferenciační potenciál [14] a vyšší schopnost mineralizace [15]. Hilkens s kol. ve své pozdější práci demonstrovali, že pokud jsou KBZD izolovány od stejného dárce, kultivovány za stejných podmínek, nezáleží na použité metodě, jelikož nezpozorovali signifikantní rozdíl v morfologii, proliferační aktivitě či diferenciačním potenciálu mezi izolovanými KBZD [16]. Záleží více na způsobech a dostupných prostředcích daného pracoviště.
Cíle studie
Cílem naší studie bylo optimalizovat proces izolace KBZD, zejména zkrátit dobu, po kterou je zubní dřeň enzymaticky štěpena, a u KBZD izolovaných novým postupem stanovit proliferační aktivitu, fenotyp, viabilitu a ověřit schopnost jejich diferenciace ve zralé buněčné typy – osteoblasty, chondroblasty a adipocyty.
Materiál a metodika
Každý dárce (pacient) byl před odběrem, respektive extrakcí zubu, seznámen s problematikou výzkumu KBZD a obsahem informovaného souhlasu. Informovaný souhlas i obsah doprovodného textu byly schváleny Etickou komisí v Hradci Králové (ref. č. 200712). Zpracování biologického materiálu za vědeckým účelem bylo schváleno stejnou komisí (ref. č. 201011 S14P). Dárci byli zařazeni do studie po podepsání tohoto informovaného písemného souhlasu či v případě nezletilých pacientů informovaný souhlas podepisoval zákonný zástupce. Po zařazení do studie byla osobní data uchovávána dle platných zákonů ČR.
Pro tento experiment jsme extrahovali celkem pět stálých zubů od dárců ve věku 14 až 18 let. Jednalo se o jeden mesiodens, dva semiretinované třetí moláry s nedokončeným vývojem kořene a dva první premoláry s nedokončeným vývojem kořene (tab. 1).
Odběr zubu
Extrakce zubu probíhala v lokálním znecitlivění za aseptických podmínek na oddělení dentoalveolární chirurgie Stomatologické kliniky LF UK a FN v Hradci Králové. Poté následovalo odstranění mikrobiálního povlaku pomocí sterilní gázy a dekontaminace zubu ponořením do 0,2% vodného roztoku chlorhexidin glukonátu po dobu 30 sekund. Ihned po extrakci byl zub uložen v uzavřené nádobě a zcela ponořen do transportního média složeného z Hankova balancovaného solného roztoku (HBSS, Invitrogen, Waltham, MA, USA) a aqua pro injectione (Bieffe Medital, Grosotto, Itálie) v poměru 1 : 9 a obohaceného o antibiotika a antimykotika – 200 μl/10 ml streptomycinu (Invitrogen), 200 μl/10 ml gentamicinu (Invitrogen), 200 μl/10 ml penicilinu (Invitrogen), 50 μl/10 ml amfotericinu (Sigma-Aldrich, St. Louis, MO). Následně byl transportován do laboratoře tkáňových kultur Ústavu histologie a embryologie LF UK v Hradci Králové, kde probíhala samotná izolace zubní dřeně, resp. KBZD. Teplota roztoku během transportu byla udržována při 4 °C.
Izolace zubní dřeně
Izolaci zubní dřeně jsme prováděli za přísně sterilních podmínek v laminárním boxu. V případě zubu s nedokončeným vývojem kořenového systému jsme pro oddělení zubní dřeně od kořene a korunky využili široce otevřené foramen apicale. Podmínkou byla minimální šířka alespoň dva milimetry, jinak tento způsob odběru nebyl možný. Pro separaci zubní dřeně od vnitřní stěny kořene jsme využili tenkou ostrou zubní sondu a mikrochirurgickou pinzetu. U zubu s plně maturovanými kořeny jsme separovali korunku zubu od kořene v místě cementosklovinné hranice pomocí Luerových kleští a opět oddělili zubní dřeň od vnitřní stěny korunky a kořene zubu sondou a pinzetou.
Enzymatická izolace kmenových buněk zubní dřeně
Pomocí sterilních nůžek jsme zubní dřeň rozstříhali na malé fragmenty o objemu do 1 mm3. Pro důkladné rozmělnění jsme tyto fragmenty dále zpracovali v tkáňovém minihomogenizátoru (Radnoti, Covina, CA, USA; obr. 1) metodou homogenizace ve směsi 1 ml transportního média a 1 ml fosfátového pufračního roztoku (PBS). Pro enzymatické štěpení jsme směs přelili do zkumavky a přidali 1 ml 0,05% trypsinu (Gibco, Thermo Fisher Scientific, Foster City, CA, USA). Zkumavku jsme následně uložili do termální vodní lázně o teplotě 37 °C na dobu 10 minut. Po této době jsme působení enzymu inhibovali přidáním 3 ml inaktivačního média, složeného z α-MEM média (Gibco) a fetálního bovinního séra (FBS, PAA Laboratories, Darthmouth, MA, USA) v 20% koncentraci. Zkumavky jsme centrifugovali při 2000 otáčkách za minutu po dobu 5 minut (600g).
Po odsátí supernatantu jsme primokulturu KBZD nasadili do kultivační nádoby o velikosti 22,5 cm2 a kultivovali v atmosféře 5% CO2 při 37 °C. Použitým kultivačním médiem bylo modifikované médium pro postnatální progenitorové mezenchymální buňky (α-MEM) obohacené o 2 % FBS, o růstové faktory – 10 ng/ml epidermálního růstového faktoru (EGF, angl. epidermal growth factor, PeproTech, London, UK), 10 ng/ml destičkového růstového faktoru (PDGF, angl. platelet-derived growth factor, PeproTech); dále o 10 mg/ml L-askorbové kyseliny (Bieffe Medital), o esenciální aminokyselinu glutamin s finální koncentrací 2 % (Invitrogen), o 50 mM dexametazonu (Bieffe Medital), o antibiotika – 100 U/ml penicilinu (Invitrogen), 100 μg/ml streptomycinu (Invitrogen), 20 μg/ml gentamicinu (Invitrogen), a dále obohacené o 10 μl/ml Insulin-Transferrin-Sodium-Selenium supplement (ITS, Sigma-Aldrich). Pasážování buněčné linie proběhlo při dosažení 70% splývavosti, kdy dochází ke kontaktní inhibici růstu buněk. Do další pasáže byly vždy buňky nasazeny v koncentraci 5000 buněk/cm2 povrchu kultivační nádoby. Kultivace byla ukončena při dosažení 8. pasáže.
Buněčná analýza
Proliferační aktivita a velikost buněk byla měřena v každé pasáži pomocí přístroje Z2-Counter (firma Beckman Coulter, Miami, FL, USA). Viabilitu buněk jsme zjišťovali na základě obarvení neviabilních buněk trypanovou modří pomocí analyzátoru Vi-Cell (Beckman Coulter) v 2. a 8. pasáži. Porovnávalo se vždy 50 zorných polí zobrazujících neviabilní (označené trypanovou modří) a viabilní buňky. Fenotyp izolovaných buněk jsme analyzovali pomocí průtokové cytometrie pomocí Cell Lab Quanta (Beckman Coulter) v 3. a 7. pasáži. Buňky byly obarveny imunofluorescenčními protilátkami konjugovanými s fluorescein izothiokyanátem (FITC) a konjugovanými s fykoerytrinem (PE) proti povrchovým znakům (angl. cluster of differentiation; CD). Procento pozitivních buněk bylo stanoveno jako procento s fluorescenční intenzitou vyšší než 99,5 % negativní isotypové imunoglobulinové kontroly.
Analyzovali jsme tyto znaky: CD10 (CB-CALLA, eBioscience, Waltham, MA), CD13 (WM-15, eBioscience), CD18 (7E4, Beckman Coulter), CD29 (TS2/16, BioLegend, San Diego, CA), CD31 (MBC 78.2, Invitrogen), CD34 (581 Class III, Invitrogen), CD44 (MEM 85, Invitrogen), CD45 (HI30, Invitrogen), CD49f (GoH3, Invitrogen), CD63 (CLBGran/12, Beckman Coulter), CD73 (AD2, BD Biosciences Pharmingen, Erembodegem, Belgie), CD90 (F15-42-1-5, Beckman Coulter), CD105 (SN6, Invitrogen), CD106 (STA, BioLegend, USA), CD117 (2B8, Chemicon, Tokyo, Japonsko), CD146 (TEA1/34, Beckman Coulter), CD166 (3A6, Beckman Coulter), HLA I (Tu149, Invitrogen) a HLA II (Tü36, Invitrogen), STRO1 (STRO-1, BioLegend). Vyjádření CD znaků jsme hodnotili podle klasifikačních kritérií: <10 % – nevyjádřeno; 11 – 40 % – nízké; 41 – 70 % – střední; >71 % – vysoké vyjádření [17].
Diferenciace
K ověření, zda jsou KBZD schopné diferencovat ve zralé buněčné typy, osteoblasty, chondroblasty a adipocyty, jsme použili komerčně dodávaná média a standardně využívané diferenciační protokoly [18, 19, 20]. Diferenciace probíhala v jedné vrstvě (buňky zachycené na dně kultivační nádoby).
Pro osteodiferenciaci jsme použili Differentiation Basal Medium-Osteogenic (Lonza, USA). KBZD byly vystaveny diferenciačnímu médiu po dosažení 70% splývavosti po dobu tří týdnů.
Jako chondrodiferenciační médium bylo využito Differentiation Basal Medium-Chondrogenic (Lonza, Basilej, Švýcarsko) obohacené o 50 μl/ml transformujícího růstového faktoru β1 (TGF-β1), přidané po dosažení 70 – 100% splývavosti v buněčné kultuře, vyměňované každé tři dny po dobu tří týdnů.
Pro diferenciaci v adipocyty jsme KBZD nechali dorůst do 100% splývavosti, poté nádobu s buňkami přelili médiem hMSC Adipogenic Induction SingleQuots (Lonza, USA) a nechali takto tři dny. Po této době jsme médium vyměnili za hMSC Adipogenic Maintenance SingleQuots (Lonza, USA) a také nechali tři dny. Tento postup jsme opakovali celkem třikrát. Poté jsme po dobu 7 dní nádobu přelili druhým uvedeným médiem, které jsme dle návodu výrobce jednou vyměnili.
Po uplynutí stanovené doby dle diferenciačních protokolů pro osteo- a chondrodiferenciaci byly buňky uvolněny od povrchu kultivačních nádob a získaný materiál byl fixován 10 – 15 minut 10% formaldehydem a přefiltrován přes filtrační papír. Materiál s filtračním papírem jsme vložili do kapsle a zpracovali v autotechnikonu. Po vyjmutí z autotechnikonu byl materiál uvolněn od filtračního papíru a zalit do parafínového bloku. Ten byl nakrájen na 7 μm silné řezy.
U diferenciace v adipocyty jsme po odstranění média a oplachu PBS diferencované KBZD fixovali 10% formaldehydem po dobu 15 minut. Opět jsme opláchli pomocí pufru a do nádoby (22,5 cm2) přidali 3,3 ml olejové červeně pro průkaz tukových vakuol v diferencovaných buňkách (tukové vakuoly obarveny červeně). Po 30 – 60 minutách a oplachu vodou jsme barevné změny ihned pozorovali pod mikroskopem.
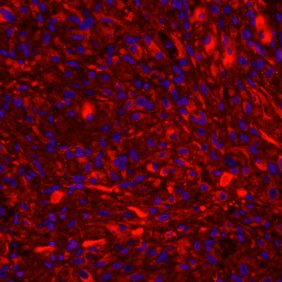
Pro průkaz chondrogenní a osteogenní extracelulární matrix jsme využili imunohistochemické i histologické barvení. Pro imunohistochemii byly vzorky nejdříve deparafínovány a permeabilizovány. Permeabilizace je metoda, která umožňuje snadnější navázání imunoprotilátek na již fixované buňky. Pro průkaz přítomnosti kolagenu typu II v chondrogenní extracelulární matrix jsme použili pufrační roztok s kozím sérem (1 : 20, Jackson ImmunoResearch Labs, Cambridgeshire, UK) s myší primární protilátkou IgM (1 : 500, Sigma-Aldrich) namířenou proti kolagenu typu II. Po navázání primární protilátky byly buňky inkubovány s kozí anti-myší IgM sekundární protilátkou konjugovanou s Cy3TM (1 : 600, Jackson ImmunoResearch Labs). Pro vizualizaci jader buněk byly vzorky dobarveny fluorescenčním barvivem 4‘,6-diamidin-2-fenylindolem (DAPI, Sigma-Aldrich). Vzorky jsme následně pozorovali fluorescenčním mikroskopem. Získané fotografie jsme navzájem překryli použitím Adobe® Photoshopu CC 2020, aby byla patrná ložiska jak s kolagenem typu II v extracelulární matrix, fluoreskující červeně, tak lokalizace jader buněk, fluoreskující modře. Pro porovnání byly vzorky také obarveny histologickým barvením. Massonův modrý trichrom byl použit pro vizualizaci kolagenu a prokolagenu v extracelulární matrix.
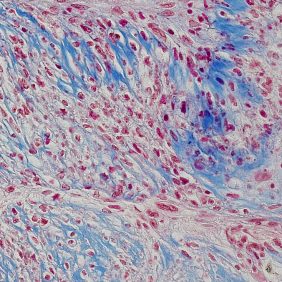
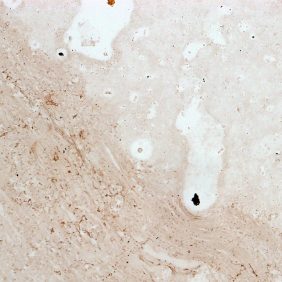
Dále jsme prokazovali přítomnost osteokalcinu, tj. primárního proteinu osteogenní matrix, s pomocí oslího séra (1 : 20, Jackson ImmunoResearch Labs) s primární IgG myší protilátkou (1 : 500. Millipore, Kankakee, IL, USA) namířenou proti osteokalcinu. Po oplachu byly vzorky s primární protilátkou inkubovány se sekundární IgG oslí anti-myší protilátkou (1 : 500, Jackson ImmunoResearch Labs), streptavidin-křenovou peroxidázou (1 : 300, Dako, Glostrup, Německo) a obarveny 3,3’-diaminobenzidinem (DAB, Sigma-Aldrich). Na konci tohoto protokolu byly vzorky dobarveny modrou skalicí (Penta) a hematoxylinem (Sigma-Aldrich). Průkaz jsme následně porovnávali se vzorky po histologickém barvení, použili jsme modrý Massonův trichrom (kolagen a prokolagen obarveny modře) a barvení dle Kossy pro průkaz vápenatých partikulí (vápník barven černě, jádra buněk červeně).
Výsledky
Úspěšně jsme izolovali celkem pět stabilních linií KBZD. Za 48 – 72 hodin po nasazení suspenze buněk získaných z enzymatického štěpení jsme v primokultuře pozorovali první KBZD, popř. jejich malé kolonie po 2 – 5 buňkách. V této době jsme kultivační médium pouze přidali. Jeho výměna následovala po 7 dnech kultivace, čímž jsme odstranili i zbytky tkání, případně zbytky ostatních buněk, které na rozdíl od KBZD neadherují ke dnu kultivační nádoby. Primokulturu jsme nechali narůst až do 70% splývavosti, poté byla pasážována.
Buněčná analýza
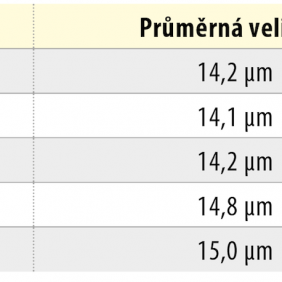
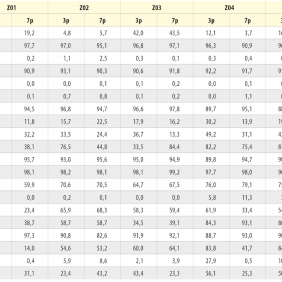
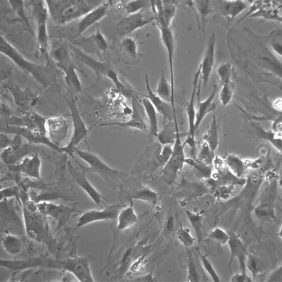
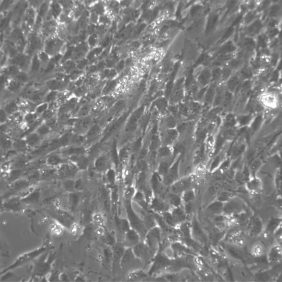
Tvar KBZD byl vřetenovitý s dlouhými výběžky a rozvinutým cytoskeletem (obr. 2a), ale pozorovali jsme také tvar více okrouhlý, s menším počtem výběžků (obr. 2b). Průměrná velikost buněk ze všech pasáží byla 14,5 ± 0,4 μm. Během celé kultivace byla viabilita přes 90 %. Průměrná hodnota v druhé pasáži byla 92,3 ± 1,5 % a v 8. pasáži byla 92,4 ± 1,4 %. Podrobný přehled velikostí a viabilit buněk ze všech linií je uveden v tabulce 2 a v tabulce 3.
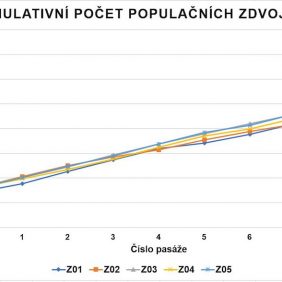
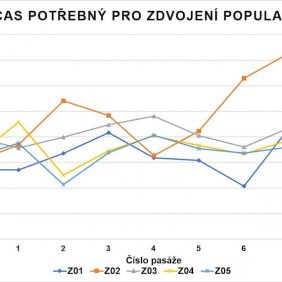
KBZD izolované enzymatickým štěpením pomocí trypsinu a metodou homogenizace zubní dřeně dosáhly průměrně 47,8 ± 2,0 PD (graf 1). Průměrný DT činil 39,2 ± 6,1 hodin (graf 2). Během dlouhodobé kultivace jsme nezaznamenali známky degenerace či spontánní diferenciace buněk.
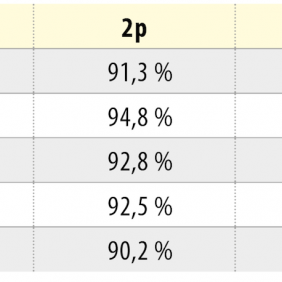
Fenotyp jsme analyzovali v 3. a 7. pasáži (3p a 7p). Celkem jsme prokazovali expresi 20 povrchových znaků (tab. 4). Během kultivace námi izolované KBZD vykazovaly v průměru vysokou pozitivitu pro CD13 (97,1 ± 0,8 % v 3p a 95,1 ± 2,4 % v 7p, CD29 (91,7 ± 0,9 % v 3p a 91,2 ± 2,2 % v 7p), CD44 (93,9 ± 4,0 % v 3p a 95,5 ± 1,2 % v 7p), CD73 (92,2 ± 1,8 % v 3p a 95,6 ± 0,9 % v 7p), CD90 (97,8 ± 0,8 % v 3p a 98,2 ± 0,85 % v 7p), CD166 (90,9 ± 1,3 % v 3p a 91,5 ± 4,8 % v 7p). Naopak negativní expresi, pod 10 %, měly znaky CD18 (0,5 ± 0,3 v 3p a 0,7 ± 0,9 % v 7p), CD31 (0,0 ± 0,1 % v 3p a 0,1 ± 0,1 % v 7p), CD34 (0,2 ± 0,3 % v 3p a 0,5 ± 0,4 % v 7p), CD106 (1,9 ± 2,3 % v 3p a 5,6 ± 7,6 % v 7p), HLA II (9,6 ± 9,7 % v 3p a 2,9 ± 3,1 %). S nízkou pozitivitou byl exprimován znak CD45 (18,3 ± 7,2 % v 3p a 16,8 ± 3,9 % v 7p). Podrobný přehled exprese CD znaků u všech buněk je uveden v tabulce 4.
Diferenciace
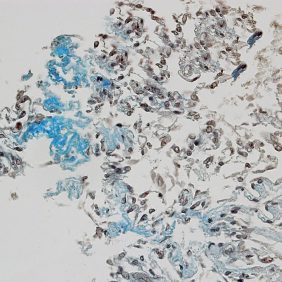
KBZD kultivované v chondrogenním, resp. osteogenním, médiu měly rozvinutější cytoskelet a do svého okolí produkovaly extracelulární matrix. Po ukončení diferenciace a zalití vzorků do parafínových bločků jsme diferenciaci dokazovali pomocí imunohistochemie a histologického barvení. Kolagen typu II po navázání protilátek fluoreskuje červeně, zatímco jádra buněk modře (obr. 3a). Kolagen a prokolagen prokázaný Massonovým trichromem jsou znázorněny modře (obr. 3b). U KBZD jsme také úspěšně indukovali osteogenezi. Imunohistochemicky jsme prokázali přítomnost osteokalcinu (hnědé okrsky na obr. 4a), za pomoci barvení modrým Massonovým trichromem přítomnost kolagenu a prokolagenu (modré okrsky na obr. 4b) a barvením dle Kossy přítomnost vápenatých partikulí (černé) ve vyprodukované osteogenní extracelulární hmotě (obr. 4c).
I přes využití protokolu ověřeného jinými autory a použití proadipogenně silně působícího média se nám nepodařilo prokázat nahromadění tukových vakuol v diferencovaných KBZD za pomoci barvení olejovou červení.
Diskuze
Od roku 2000, kdy byly KBZD poprvé izolovány, zájem o ně neustále stoupá. Jejich relativně snadná izolace a pozoruhodné vlastnosti, schopnost sebeobnovy a diferenciace tyto buňky předurčuje k využití v regenerativní a reparativní medicíně. Díky jejich embryonálnímu původu mají KBZD široké potenciální uplatnění. Počáteční výsledky výzkumů in vitro ukazují na možnost budoucího využití KBZD v léčbě endokrinních poruch (diabetu), akutního infarktu myokardu, v regenerativní léčbě onemocnění kostí (osteoporózy), chrupavek (osteoartritidy), neurodegenerativních onemocnění (léčby Parkinsonovy choroby, Alzheimerovy choroby, cévní mozkové příhody, poškození míchy, periferního nervu po úrazu) [21, 22].
Ze dvou technik izolace je pro KBZD obecně více přijímána metoda enzymatické disociace zubní dřeně. Jedná se o vícekrokový postup, který je technicky náročnější než metoda spontánního vycestování.
Ferrúa a kol. ve své přehledové studii vycházející z 202 článků, popisují 19 možných kombinací, resp. jednotlivých enzymů, které byly popsány a úspěšně využity k izolaci KBZD [6]. Nejčastěji se jedná o směs kolagenázy typu I, štěpící kolagen typu I a dispázy, štěpící fibronektin a kolagen typu IV [10, 11]. Doba enzymatického štěpení zubní dřeně touto kombinací v poměru koncentrací 1 : 1 je 30 – 60 minut. Rozmezí se liší dle velikosti fragmentů. Dalšími popisovanými enzymy jsou například trypsin nebo DNáza. Doba působení enzymů je v izolačním protokolu stěžejní a může negativně ovlivnit viabilitu kmenových buněk, které jsou izolovány. Při dlouhém působení se může enzym stát pro buňky až toxickým [12]. Vždy je proto snaha zkrátit dobu působení enzymu na minimum. Prvním předpokladem, jak zkrátit dobu enzymatické izolace, je důkladné rozmělnění celé tkáně na fragmenty. K tomuto účelu jsme využili efektivní metodu homogenizace. Při tomto způsobu zpracování dochází ke vzniku homogenní suspenze rozmělněním tkáně třením o stěny nádoby za přítomnosti vhodného roztoku. Nejčastěji se využívá izotonický roztok, tak aby se zabránilo osmotickému poškození [23].
Principem enzymatické izolace KBZD je proteolýza s cílem získat suspenzi buněk z tkáně zubní dřeně. Trypsin je proteolytický enzym využívaný v laboratoři tkáňových kultur zejména pro pasážování buněk, kdy štěpí proteiny odpovědné za adhezi buněk ke dnu kultivační nádoby. V naší studii jsme se proto zaměřili na využití trypsinu k izolaci KBZD.
V naší práci jsme pomocí nového postupu izolovali celkem pět linií KBZD. Dominantní tvar buněk byl vřetenovitý s dlouhými výběžky a rozvinutým cytoskeletem. Tento tvar je také charakteristický pro KBZD izolované z perivaskulární zóny zubní dřeně [23]. Více okrouhlý tvar s menším počtem výběžků je naopak typický pro KBZD získané ze subodontoblastické zóny [24]. Salehinejad a kol. [25] porovnávali mezenchymové kmenové buňky izolované z pupečníku pomocí směsi kolagenázy/hyaluronidázy/trypsinu, kolagenázy/trypsinu a pouze trypsinu. Došli k závěru, že největší výtěžnost izolovaných buněk byla v případě použití trypsinu v koncentraci 2,5 mg/ml při působení po dobu 30 minut. Přesto takto izolované kmenové buňky po 30 dnech kultivace dále neproliferovaly. V předkládaném protokolu jsme při koncentraci trypsinu 0,05 % zkrátili dobu izolace na 10 minut a dle dostupných údajů v současné literatuře se jednalo o první protokol využívající trypsin pro izolaci KBZD, kdy izolované buňky byly proliferačně aktivní až do 8. pasáže a měly viabilitu přes 90 %.
KBZD kultivované do 8. pasáže překročily 40 populačních zdvojení.
Obecně platí, že kmenové buňky mají schopnost adherovat k přilnavému povrchu a mají vyjádřené specifické povrchové znaky, povrchové CD antigeny [26]. Dle fenotypové analýzy námi izolované KBZD vykazovaly vysokou pozitivitu CD znaků mezenchymových kmenových buněk, tj. CD29, CD44 a CD90. Dále byly vysoce vyjádřeny tzv. „stromal-associated“ antigeny CD13, CD73 a CD166 (angl. activated leukocyte cell adhesion molecule; ALCAM), tj. adhezivní molekula zodpovědná za regulaci denzity a za migraci buněk. Naopak negativní exprese CD34 (angl. hematopoietic stem cell marker, prekurzor hematopoetických buněk) a nízká pozitivita CD45 (receptor typu C proteinové tyrosin fosfatázy, vyskytující se v různých isoformách na všech hematopoetických buňkách mimo červených krvinek a plazmatických buněk [27]) potvrzuje, že hematopoetické prekurzory nejsou přítomny v zubní dřeni. Lehce zvýšená exprese CD45 může být vysvětlena přítomností ITS v kultivačním médiu. Takto obohacené médium ponechává KBZD méně diferencované s vyšší variabilitou se diferencovat ve zralé buněčné typy [28]. U izolovaných buněk nebyla také vyjádřena adhezivní molekula destiček a buněk endotelu CD31.
U všech izolovaných linií jsme úspěšně prokázali diferenciaci ve zralé buněčné populace. KBZD se diferencovaly v buňky podobné osteoblastům a chondroblastům a začaly produkovat extracelulární hmotu. Bohužel, i přes proadipogenně silně působící médium buňky nediferencovaly v adipocyty. Na rozdíl od mezenchymových buněk kostní dřeně, které fyziologicky inklinují k této buněčné řadě, jelikož i v průběhu života je kostní dřeň nahrazována tukovou tkání, KBZD tuto vlastnost nemají a v tukové buňky nediferencují. Schopnost kmenových buněk diferencovat v adipocyty může být ovlivněna i prostředím (niché), ve kterém se KBZD nacházejí.
Závěr
Optimalizovali jsme proces izolace KBZD tím, že jsme zkrátili dobu, po kterou je zubní dřeň enzymaticky štěpena. Čas potřebný pro dostatečné uvolnění KBZD ze zubní dřeně jsme pomocí nové metody zkrátili z obvyklých 30 až 60 minut na 10 minut, a to díky využití metody homogenizace tkáně zubní dřeně a změny enzymu využitého pro štěpení. Fenotypovou analýzou jsme dokázali přítomnost povrchových antigenů pro mezenchymové kmenové buňky, a naopak negativní či nízké vyjádření znaků hematopoetické buněčné řady. Po celou dobu kultivace se procento živých buněk pohybovalo přes 90 %, buňky byly proliferačně aktivní a spontánně nediferencovaly. KBZD jsme úspěšně diferencovali ve zralé buněčné typy, osteoblasty a chondroblasty.
Obrazová dokumentace
Literatura
1. Morrison SJ, Spradling AC. Stem cells and niches: mechanisms that promote stem cell maintenance throughout life. Cell. 2008; 132(4): 598 – 611.
2. Schofield R. The relationship between the spleen colony-forming cell and the haemopoietic stem cell. Blood Cells. 1978; 4(1 – 2): 7 – 25.
3. Gronthos S, Mankani M, Brahim J, Robey PG, Shi S. Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo. Proc Natl Acad Sci USA. 2000; 97(25): 136.
4. Gronthos S, Brahim J, Li W Fisher LW, Cherman N, Boyde A, DenBesten P, Robey PG, Shi S. Stem cell properties of human dental pulp stem cells. J Dent Res. 2002; 81(8): 531 – 535.
5. Huang GT, Gronthos S, Shi S. Mesenchymal stem cells derived from dental tissues vs. those from other sources: their biology and role in regenerative medicine. J Dent Res. 2009; 88(9): 792 – 806.
6. Ferrúa CP, Centeno EGZ, Rosa LC, Amaral, Severo CC, Sarkis-Onofre RF, Nascimento GG, Cordenonzi G, Bast RK, Demarco FF, Nedel F. How has dental pulp stem cells isolation been conducted? A scoping review. Braz. Oral Res. 2017; (31): e87.
7. Bressan E, Ferroni L, Gardin C, Pinton P, Stellini E, Botticelli D, Sivolella S, Zavan B. Donor age-related biological properties of human dental pulp stem cells change in nanostructured scaffolds. PLoS One. 2012; 7(11): e49146.
8. Park SH, Hsiao GY, Huang GT. Role of substance P and calcitonin gene-related peptide in the regulation of interleukin-8 and monocyte chemotactic protein-1 expression in human dental pulp. Int Endod J. 2004; 37(3): 185 – 192.
9. Spath L, Rotilio V, Alessandrini M, Gambara G, De Angelis L, Mancini M, Mitsiadis TA, Vivarelli E, Naro F, Filippini A, Papaccio G. Explant-derived human dental pulp stem cells enhance differentiation and proliferation potentials. J Cell Mol Med. 2010; 14(6B): 1635 – 1644.
10. Fogarty WM, Griffin PJ. Production and purification of the metalloprotease of Bacillus polymyxa. Appl Microbiol. 1973; 26(2): 185 – 190.
11. Kühn K. Basement membrane (type IV) collagen. Matrix Biologzy. 1995; 14(6): 439 – 44.
12. Lindner U, Kramer J, Rohwedel J, Schlenke P. Mesenchymal Stem or Stromal Cells: Toward a Better Understanding of Their Biology? Transfus Med Hemother. 2010; 37: 75 – 83.
13. Nakashima M. Establishment of primary cultures of pulp cells from bovine permanent incisors. Arch Oral Biol. 1991; 36(9): 655 – 663.
14. Huang GT, Sonoyama W, Chen J, Park SH. In vitro characterization of human dental pulp cells: various isolation methods and culturing environments. Cell Tissue Res. 2006; 324(2): 225 – 236.
15. Karamzadeh R, Eslaminejad MB, Aflatoonian R. Isolation, characterization and comparative differentiation of human dental pulp stem cells derived from permanent teeth by using two different methods. Vis Exp. 2012; 69: 4372.
16. Hilkens P, Gervois P, Fanton Y, Vanormelingen J, Martens W, Struys T, Politis C, Lambrichts I, Bronckaers A. Effect of isolation methodology on stem cell properties and multilineage differentiation potential of human dental pulp stem cells. Cell Tissue Res. 2013; 353(1): 65 – 78.
17. Suchánek J, Visek B, Soukup T, El-Din Mohamed SK, Ivančaková R, Mokrý J, Aboul-Ezz EH, Omran A. Stem cells from human exfoliated deciduous teeth – isolation, long term cultivation and phenotypical analysis. Acta Medica (Hradec Kralove). 2010; 53(2): 93 – 99.
18. Coelho MJ, Fernandes MH. Human bone cell cultures iin biocompatibility testing. Part II: effect of ascorbic acid, beta-glycerophosphate and dexamethasone on osteoblastic differentiation. Biomaterials. 2000; 21(11): 1095 – 1102.
19. Gronthos S, Graves SE, Ohta S, Simmons PJ. The STRO-1 + fraction of adult human bone marrow contains the osteogenic precursors. Blood. 1994; 84(12): 4164 – 4173.
20. Haynesworth SE, Barber MA, Caplan IA. Cell surface antigens on human marrow-derived mesenchymal cells are detected by monoclonal antibodies. Bone. 1992; 13(1): 69 – 80.
21. Yang X, Li L, Xiao L, Zhang D. Recycle the dental fairy’s package: overview of dental pulp stem cells. Stem Cell Res Ther. 2018; 9: 347.
22. Nuti N, Corallo C, Chan BM, Ferrari M, Gerami-Naini B. Multipotent differentiation of human dental pulp stem cells: a literature review. Stem Cell Reviews and Reports. 2016; 12(5): 511 – 523.
23. Káš J, Kodíček M, Valentová O. Laboratorní techniky biochemie. 1. vydání. Praha: Vysoká škola chemicko-technologická v Praze; 2006, 10.
24. Suchánek J, Soukup T, Ivančaková R, Karbanová J, Hubková V, Pytlík R, Kučerová L. Human dental pulp stem cells – isolation and long term cultivation. Acta Medica (Hradec Králové). 2007; 50(3): 195 – 201.
25. Salehinejad P, Alitheen NB, Ali AM, Omar AR, Mohit M, Janzamin E, Samani FS, Torshizi Z, Nematollahi-Mahani SN. Comparison of different methods for the isolation of mesenchymal stem cells from human umbilical cord Wharton‘s jelly. In Vitro Cell Dev Biol Animal. 2012; 48(2):75 – 83.
26. Krebsbach PH, Villa-Diaz LG. The Role of Integrin a6 (CD49f) in Stem Cells: More than a Conserved Biomarker. Stem cells and development. 2017; 26(15): 1090 – 1099.
27. Cong R, Yang J, Zhou J, Shi J, Zhu Y, Zhu J, Xiao J, Wang P, He Y, He B. The potential role of protein tyrosine phosphatase, receptor type C (CD45) in the intestinal ischemia-reperfusion injury. J Comput Biol. 2020; 27(8): 1303 – 1312. doi: 10.1089/cmb.2019.0244
28. Suchánek J, Suchánková Kleplová T, Kapitán M, Soukup T. The effect of fetal calf serum of human dental pulp stem cells. Acta Medica (Hradec Králové). 2013; 56(4): 142 – 149.
19. 12. 2020
Print: LKS. 2020; 30(12): 210 – 218
Autoři:
Fotografie
- Archiv autorů
Rubrika:
Téma: