Jak úspěšně napravit neúspěch / Test 10
Medikační osteonekróza čelisti
Test 10
Na podzim roku 2008 byla na naši ambulanci odeslána ošetřujícím klinickým onkologem 56letá pacientka, důvodem byly silné bolesti v oblasti dolní čelisti vpravo. Pacientce byl dříve (v roce 2001) diagnostikován karcinom prsu, pročež v témže roce podstoupila ablaci levého prsu s následnou chemoterapií a radioterapií. V květnu 2005 byla zjištěna generalizace do skeletu a následně byla zahájena hormonální léčba (letrozol) a antiresorpční terapie bisfosfonáty (kys. zoledronová, od 4/2008 byla terapie změněna pro zhoršení ledvinných funkcí na kys. ibandronovou). Pacientka nebyla léčena pro žádné jiné chronické onemocnění, neužívala žádné jiné léky.
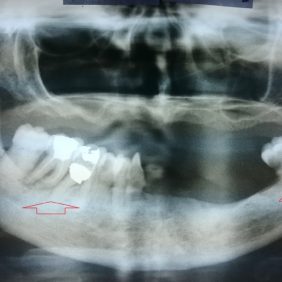
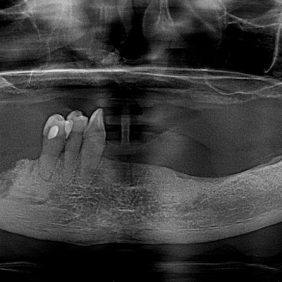
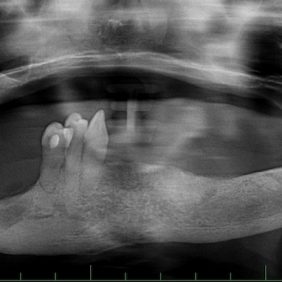
Při intraorálním vyšetření a na ortopantomogramu (obr. 1) byly zjištěny kariézní zuby 38, 48, 47 a trepanovaný (ponechaný volně) zub 46, dále pak viklavost prvního stupně u zubů 45, 44, 43. Maximum bolesti bylo v oblasti zubů 48, 47, 46, okolní dáseň byla bez známek zánětu.
V den první návštěvy byla provedena extrakce zubů 48, 47, 46, a to v souladu s tehdejšími doporučeními pro pacienty užívající bisfosfonáty (podání antibiotik – klindamycin 2 x 300 mg cps, šetrná extrakce a sutura rány). Po extrakci byla ordinována antibiotika, konkrétně klindamycin, 300 mg každých 8 hod. (1 balení). Do týdne byla stejným způsobem provedena i extrakce zubu 38. Při kontrole za týden se bolest výrazně zmírnila, intraorálně se rány hojily.
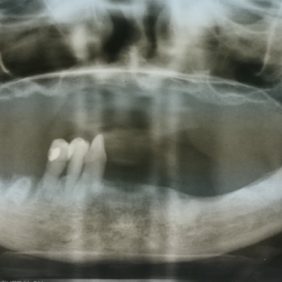
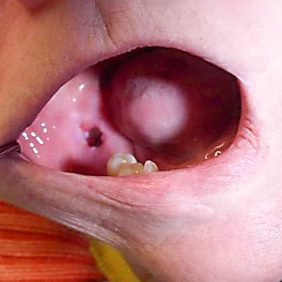
Za tři měsíce (obr. 2) se ale pacientka dostavila s výraznou bolestí v oblasti extrahovaných zubů. Rány po extrakcích byly nezhojené a byla patrná malá část obnažené kosti s purulentní exsudací po palpaci. Sliznice v okolí ran byla zarudlá se známkami zánětu.
Otázky:
1. O jakou diagnózu se s největší pravděpodobností jedná?
2. Při kterých onkologických onemocněních je podávána antiresorpční, eventuálně antiangiogenní terapie?
3. Jaké jsou možnosti dalšího postupu?
Test 10 – řešení
Ad 1: U pacientky byla diagnostikována bisfosfonátová nekróza (BRONJ – Bisphosphonate-Related Osteonecrosis of the Jaw) v druhém stadiu, což znamená přítomnost viditelné nekrotické kosti se známkami zánětu v okolí.
V roce 2008 nebyl popsán výskyt osteonekróz při jiné antiresorpční terapii kostních metastáz než při lécích ze skupiny bisfosfonátů, nyní již však víme o více lécích modifikujících kostní metabolismus spojených s výskytem ONJ, proto je nyní používán souhrnný název MRONJ (Medication-Related Osteonecrosis of the Jaw), což se dá přeložit jako medikační osteonekróza čelisti (1).
Abychom mohli prohlásit, že pacient má MRONJ, musí být splněno následující (1):
- Užívá nebo v minulosti užíval antiresorpční nebo antiangiogenní léky.
- Exponovaná kost nebo kost, která je sondovatelná přes intra- nebo extraorální píštěl v maxilofaciální oblasti, je přítomna déle než 8 týdnů.
- Pacient v minulosti neprodělal radioterapii v oblasti čelistí, ani nebylo zjištěno jejich metastatické postižení.
Stadia MRONJ dle AAOMS – Americké asociace pro ústní a maxilofaciální chirurgii (1):
- Stadium 0: bez přítomnosti obnažené nekrotické kosti čelistí, pacient má nespecifické příznaky, které není možné jinak diagnostikovat: brnění čelistí, pobolívání, hypestezie.
- Stadium 1: nebolestivá, obnažená nekrotická kost bez známek infekce.
- Stadium 2: bolestivá, obnažená nekrotická kost čelisti se známkami infekce.
- Stadium 3: velký rozsah nekrotické kosti, ev. s komplikacemi (nekróza zasahuje k dolnímu okraji mandibuly, do čelistní dutiny, do lícní kosti, patologická zlomenina, oroantrální/oronazální komunikace, zevní píštěl…).
Ad 2: Antiresorpční terapie je nejčastěji indikována u onkologických pacientů léčených pro mnohočetný my elom, dále pak u pacientů s metastatickým postižením kostí, a to nejčastěji při karcinomu prsu, prostaty, plic a ledvin. S antiangiogenní biologickou léčbou se setkáváme nejčastěji u pacientů s kolorektálním karcinomem, nádory plic, pleury a mediastina, zhoubnými gynekologickými nádory, zhoubnými nádory ledvin a močového měchýře, zhoubnými nádory prsu, trávicí trubice (žaludku) a pankreatu (8, 11).
Ad 3: Při řešení MRONJ volíme mezi konzervativním a chirurgickým přístupem. Při použití chirurgického přístupu je nutná radikální resekce nekrotické kosti, respektive čelisti. Při volbě je nutné přistupovat k pacientovi individuálně a posoudit jeho celkový zdravotní stav ze všech možných aspektů. Stejně tak je nutné posoudit samotnou osteonekrózu včetně odhadu její velikosti, ačkoliv přesné určení je často možné teprve přímo při chirurgickém výkonu.
Na základě našich současných zkušeností dnes již můžeme říci, že zásadní rozdíl mezi těmito dvěma přístupy je, že u chirurgického přístupu máme relativně dobré vyhlídky stran úplného zhojení oste onekrózy, u konzervativního přístupu je šance menší a efekt spočívá spíše v eliminaci potíží a snížení dyskomfortu pacienta (bolest, otok, zánětlivé komplikace apod.). Každé pracoviště má k této problematice jiný přístup, názory stále nejsou plně jednotné, přesto se dá říci, že v současné době se stále více pracovišť přiklání spíše k chirurgickému řešení, který preferujeme i na našem pracovišti (7, 10).
Pokračování kazuistiky
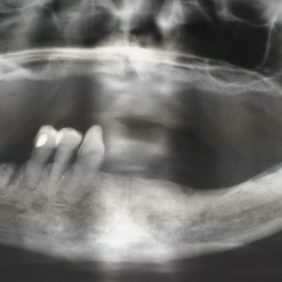
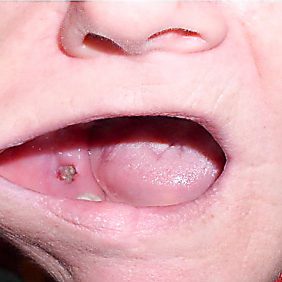
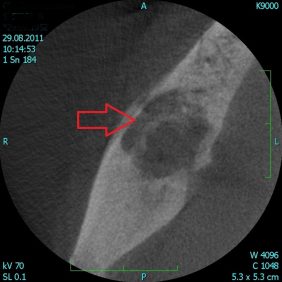
V roce 2008 jsme ještě s chirurgickým řešením těchto osteonekróz zkušenosti neměli, a proto jsme zvolili konzervativní přístup. Pacientka během následujících 3,5 let prodělala několik zklidnění s následnou exacerbací zánětu v oblasti MRONJ (obr. 3), přičemž terapií bylo vždy dlouhodobé přeléčení antibiotiky (antibiotikem první volby byl klindamycin 300 mg à 8 hod., druhé volby amoxicilin s kys. klavulonovou). Po empirickém předepsání klindamycinu jsme dle výsledků kultivací podali i metronidazol, ciprofloxacin, klaritromycin, amoxicilin s klavulanátem a doxycykin. Odběry na mikrobiologické vyšetření byly prováděny z místa oste onekrózy standardním způsobem. Rány jsme vyplachovali antiseptiky, nejčastěji peroxidem vodíku, a odstraňovali povrchové, změklé, nekrotické části kostí. Po domluvě s ošetřujícím onkologem byla bisfosfonátová terapie přerušena, načež došlo v místě nekrózy k vytvoření kostního sekvestru (obr. 4), který se zčásti uvolnil sám a zčásti byl námi jednoduše, bez nutnosti chirurgické intervence, odstraněn (obr. 5), (obr. 6), (obr. 7). V té době vypadala léčba nadějně a mohli jsme doufat, že hojení bude pokračovat do úplného vyřešení problému.
U pacientky se však objevilo postupné zhoršování spojené s parestezií a hyp e-
s tezií v oblasti n. alveolaris inferior vpravo a exacerbace zánětlivých potíží s otokem a bolestmi. Podle dostupných literárních zdrojů jsme tedy po domluvě s onkology zahájili léčbu pentoxifyllinem a α-tokoferolem (200 mg 2 x 1 po dobu dvakrát dvou měsíců) s antiseptickými výplachy chlorhexidinem 2x denně, očekávané zlepšení stavu se však neobjevilo. Osteonekróza progredovala a zároveň došlo ke zhoršení celkového stavu kostních metastáz.
V únoru 2010 byla onkologická hormonální terapie vyčerpána a paliativní chemoterapie nebyla vzhledem k oste onekróze čelisti a celkovému stavu pacientky až do další progrese onkologického onemocnění či orgánového postižení indikována.
Chirurgické řešení
V srpnu 2012 jsme vzhledem k neúspěšnosti konzervativní terapie přistoupili k chirurgickému řešení, kdy jsme v celkové anestezii pod antibiotickou clonou (amoxicilin s kys. klavulanovou p. o. nasazený 3 dny před výkonem) provedli radikální odstranění nekrotické kosti v oblasti zubů 48, 47, 46 s excizí zánětlivě změněné sliznice a změněného periostu z okolí oste onekrózy, přičemž jsme odebrali do anaerobního prostředí vzorky pro mikrobiální vyšetření. Provedli jsme laváž H2O2 a ránu primárně hermeticky suturovali. Pacientka trvala na ponechání zubů 45, 44, 43 a vzhledem k tomu, že kost v oblasti daných zubů se nám během výkonu jevila zdravá, toto bylo možné uskutečnit.
S odstupem cca 2 – 3 týdnů po výkonu došlo k mírné dehiscenci, která se ale po lokálním ošetřování a cíleném přeléčení antibiotiky dle výsledků mikrobiologického vyšetření odebraného při operaci (ciprofloxacin) uzavřela. Oblast oste onekrózy opět přeepitelizovala a pacientka byla bez bolestí. Postupně došlo i ke zlepšování parestezie n. alveolaris inferior vpravo – nerv procházel přímo nekrózou, ale během výkonu nebyl přerušen (obr. 8).
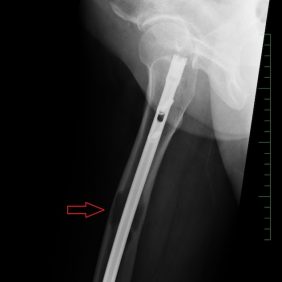
Během následujících dvou let byla pacientka bez potíží týkajících se oste onekrózy, nebyla nutná extrakce žádného dalšího zubu, pouze úprava dolní částečně snímatelné náhrady ošetřujícím zubním lékařem. Základní onkologické onemocnění nicméně během let progredovalo, v 8/2012 byly opět nasazeny bisfosfonáty (klodronát), který byl změněn v 2/2014 na denosumab. Pacientka prodělala preventivní osteosyntézu femuru (obr. 9) pro metastatické postižení s následnou analgetickou radioterapií (8).
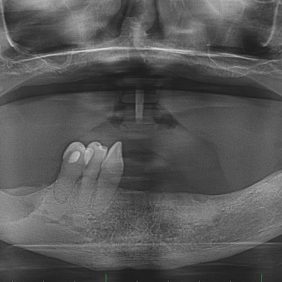
Při kontrolním OPG v 8/2014 (obr. 10) byla zjištěna zlomenina levého kloubního výběžku dolní čelisti. Vzhledem k tomu, že pacientka úraz negovala, byla bez subjektivních potíží a horní totální náhrada i dolní částečně snímatelná protéza jí vyhovovaly, žádnou chirurgickou intervenci jsme neindikovali.
Pacientka zemřela v 8/2015, 14 let od diagnostikování onkologického onemocnění a 9 let po nálezu generalizace do skeletu. Bezprostřední příčinou smrti bylo náhlé srdeční selhání.
Nové otázky:
4. Je možné vzniku medikační osteonekrózy, eventuálně jejímu rozvoji nějak předejít?
5. Jak bychom pravděpodobně postupovali dnes?
Ad 4: Ne. Vzhledem k tomu, že MRONJ je multifaktoriální onemocnění, prakticky se nedá jednoznačně určit, kdy a proč osteonekróza vznikla. V daném případě mohlo být důvodem, proč se ošetřující PZL rozhodl zub 46 trepanovat, stadium 0 oste onekrózy, které je bez přítomnosti exponované kosti a je spojené s nespecifickými obtížemi pacienta. Zub se poté stal cestou, kterou se šířila infekce do kosti, a jelikož kost již nebyla schopna standardně reagovat, ani následné extrakce již nebyly definitivním vyřešením situace. Toto je ale jen jedna z možných hypotéz vzniku a přesné příčiny se pravděpodobně nikdy nedobereme (1).
Přestože nejsme schopni plně předejít vzniku ONJ/MRONJ, jsme schopni určitými preventivními opatřeními riziko vzniku minimalizovat. Ať je to způsob extrakce (viz ad 5), tak důkladné cílené vyšetření a následné ošetření před nasazením (ale i během) antiresorpční léčby.
Ad 5: Dnes bychom při první návštěvě pacienta nasadili empiricky antibiotika a naordinovali důkladnou hygienu dutiny ústní chlorhexidinovými výplachy. Antibiotiky první volby nyní volíme širokospektré peniciliny s inhibitory beta-laktamáz, při alergii na peniciliny klindamycin. S několikadenním odstupem (3 – 5 dní) bychom provedli chirurgické extrakce zubů 48, 47, 46, ev. 38, s odklopením mukoperiostálního laloku a následnou důkladnou egalizací ostrých kostních okrajů a sept do jejich šířky alepoň 1,5 – 2 mm. Ránu bychom hermeticky uzavřeli primární suturou. Pacient by doužíval antibiotika a dodržoval hygienu dutiny ústní. Po extrakcích pak standardně kontrolujeme pacienty s odstupem dvou týdnů, kdy eventuálně odstraňujeme stehy z rány, další kontrola probíhá po 6 – 8 týdnech. Za úspěšné zhojení považujeme vznik neporušeného slizničního krytu v místě výkonu (6, 10).
Pokud by i přes naši snahu vznikla MRONJ, provedli bychom CT (respektive CBCT) vyšetření a následně co nejdříve přistoupili rovnou k chirurgickému řešení, pravděpodobně v celkové anestezii. Při chirurgické terapii nyní využíváme k detekci vitální kosti fluorescence tetracyklinového antibiotika, které se naváže ve vitální kosti a následně při osvícení fluorescenční lampou (UVA záření až viditelné fialovo–modré světlo) živá kost fluoreskuje (10), zatímco nekrotická kost zůstává tmavá.
Vysazování či úprava antiresorpční či jiné onkologické terapie je možná pouze indikujícím lékařem, v tomto případě onkologem. V některých případech onkologové své pacienty s MRONJ s námi konzultují, poté většinou sdělujeme, že z naší indikace není bisfosfonátovou terapii nutné přerušovat (7, 8, 9, 11, 12).
V případě oste onekrózy způsobené denosumabem bychom podle našich prvních zkušeností podávání na nejkratší možnou dobu doporučili přerušit (vynechání dávky před výkonem a odsunutí podání dávky po zhojení slizničního krytu) nebo na kratší dobu dali onkologům ke zvážení nasazení bisfosfonátů.
Shrnutí
MRONJ byla poprvé popsána v roce 2003, od té doby již vstoupila do obecného povědomí lékařů jak na klinických pracovištích, tak i u praktických zubních lékařů. Přístup k této problematice se stále vyvíjí, měl by být vždy individuální a multidisciplinární, i proto nepanuje shoda na jednoznačném postupu ani mezi jednotlivými pracovišti. Problematika bisfosfonátové oste onekrózy je dále intenzivně prozkoumávána a v současné době je již množství dostupných informací relativně značné. Na základě našich zkušeností se již nebojíme chirurgického řešení a naopak ho velmi často využíváme.
Ve stejných indikacích jako bisfosfonáty se však v současné době objevují nové léky, nejčastěji denosumab, které mohou osteonekrózu způsobovat také. Vzhledem k tomu, že mechanismus účinku a farmakokinetické vlastnosti denosumabu jsou však jiné než u bisfosfonátů, bude třeba dalšího výzkumu a zkušeností, aby se dalo s jistotou říci, jestli bude možné aplikovat při řešení stejný přístup, nebo bude nutné jej změnit.
Rádi bychom v souvislosti s tím to pří padem poukázali ještě na jednu skutečnost. Naše pacientka zemřela 14 let od diagnostikování onkologického onemocnění, 9 let po nálezu generalizace do skeletu a bezprostřední příčinou smrti bylo srdeční selhání. Z našeho pohledu se po celou dobu jevila plně soběstačná, spolupracující, a pokud nám bylo známo, vedla plnohodnotný život. U této pacientky vidíme, že jsme se nesnažili zbytečně – tři roky žila bez přítomnosti oste onekrózy, nosila zubní náhrady, mohla jíst a mohla se smát. Moderní medicína jde mílovými kroky vpřed a diagnóza, která dříve znamenala prognózu života několik málo měsíců, se úspěšnou onkologickou léčbou posouvá do řádů let (viz níže komentář MUDr. Jiřího Tomáška, Ph.D., k přežívání pacientů s kostními metastázami). Požadavky na kvalitu života se mění, rostou, a my nejsme ti, kdo by ve chvíli, kdy uslyšíme slovo metastáza, měli nad pacienty lámat hůl a přestat se snažit o vyřešení jejich problémů.
Jakou má prognózu pacient s kostními metastázami?
MUDr. Jiří Tomášek, Ph.D.
Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno
Primární nádory kostí jsou vzácné a vyskytují se především u dětí a mladých dospělých. Naopak kostní metastázy karcinomů prsu, plic, prostaty nebo ledvin jsou běžné. S kostními metastázami se setkáváme v posledních letech častěji také u pacientů s kolorektálním karcinomem. Je to dáno dříve neobvyklým víceletým přežíváním některých pacientů, u kterých se postupně selektují agresivnější klony nádorových buněk.
Karcinom prsu typicky metastazuje do skeletu. Asi u 70 % pacientek, které zemřou na karcinom prsu, jsou radiologicky kostní metastázy prokazatelné. Medián přežití od zjištění první kostní metastázy se pohybuje kolem 2 let, tedy polovina pacientek žije déle než 2 roky. Pacientky pouze s kostními metastázami mají výrazně lepší prognózu oproti případům s viscerálními metastázami (např. játra). Běžně se setkáváme s pacientkami, které žijí normálním životem 5 a více let s dobře kontrolovanými kostními metastázami.
Karcinom prostaty je také typický metastázováním do skeletu a podobně jako u karcinomu prsu mají lepší prognózu pacienti pouze s kostními metastázami oproti případům s také extraoseálním postižením. Medián přežití pacientů s karcinomem prostaty v dobrém výkonnostním stavu, u kterých byly zjištěny pouze kostní metastázy, přesahuje 4 roky. Pokud jsou i viscerální metastázy, je to 2,5 roku a u pacientů v horším výkonnostním stavu s kostními a viscerálními metastázami je medián přežívání asi 12 měsíců.
Prognóza pacientů s plicním karcinomem metastázujícím do skeletu je horší a pohybuje se řádově v měsících.
U všech pacientů je vždy nutné zvážit prospěch a rizika léčby.
Léčba kostní nádorové nemoci bisfosfonáty nebo denosumabem snižuje riziko kostních komplikací, udržuje mobilitu pacienta, jeho funkční zdatnost, mírní bolesti a zlepšuje kvalitu života.
Summary
How to retrieve failure succesfully
Test 10: MRONJ – Medication-Related Osteonecrosis of the Jaw
The Medication-Related Osteonecrosis of the Jaw (MRONJ) is a disease that may appear in patients treated by bisphosphonates or other antiresorptive therapy such as denosumab. Both conservative and surgical approach to its treatment are possible. This paper summarizes a case of a patient with MRONJ who, after being unsuccessfully treated by a conservative therapy, was completely cured by the surgical treatment. A detailed step-by-step analysis of the case is provided along with recommendations for therapy according to our up-to-date experience with this type of affliction.
Obrazová dokumentace
Literatura
1. Ruggiero SL, Dodson TB, Fantasia J, et al. American Association of Oral and Maxillofacial Surgeons Position Paper on Medication–Related Osteonecrosis of the Jaw – 2014 Update. Journal of Oral and Maxillofacial Surgery, 2014, 72(10): 1938–1956.
2. Guttenberg SA. Bisphosphonates and bone... What have we learned? Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology and Endodontology, 2008, 106(6): 769–772.
3. Montebugnoli L, Felicetti L, Gissi DB, Pizzigallo A, Pelliccioni GA, Marchetti C. Biphosphonate-associated osteonecrosis can be controlled by nonsurgical management. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology and Endodontology, 2007, 104(4): 473–477.
4. Marx RE, Cillo JE Jr, Ulloa JJ. Oral bisphosphonate-induced osteonecrosis: risk factors, prediction of risk using serum CTX testing, prevention, and treatment. Journal of Oral and Maxillofacial Surgery, 2007, 65(12): 2397–2410.
5. Epstein MS, Wicknick FW, Epstein JB, Berenson JR, Gorsky M. Management of bisphosphonate-asociated osteonecrosis: pentoxifylline and tocopherol in addition to antimicrobial therapy. An initial case series. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology and Endodontology, 2010, 110(5): 593 – 596.
6. Heufelder MJ, Hendricks J, Remmerbach T, Frerich B, Hemprich A, Wilde F. Principles of oral surgery for prevention of bisphosphonate-related osteonecrosis of the jaw. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, 2014, 117(6): 429 – 435.
7. Koch FP, Walter C, Hansen T, Jager E, Wagner W. Osteonecrosis of the jaw related to sunitinib. Oral and Maxillofacial Surgery, 2011, 15(1): 63–66.
8. Gallego L, Junquera L. Consequence of therapy discontinuation in bisphosphonate-associated osteonecrosis of the jaws. British Journal of Oral and Maxillofacial Surgery, 2009, 47(1): 67 – 68.
9. Pautke C, Bauer F, Tischer T, Kreutzer K, et al. Fluorescence-guided bone resection in bisphosphonate- associated osteonecrosis of the jaws. Journal of Oral and Maxillofacial Surgery, 2009, 67(3): 471 – 476.
10. Wang X, Yang KH, Wanyan P, Tian JH. Comparison of the efficacyand safety of denosumab versus bisphosphonates in breast cancerand bone metastases treatment: A meta-analysis of randomized controlled trials. Oncology Letters, 2014, 7(6): 1997–2002.
11. Utreja A, Almas K, Javed F. Dental extraction as a risk factor for bisphosphonate relatedosteonecrosis of the jaw in cancer patients: an update. Odonto-stomatologie Tropicale, 2013, 36(142): 38–46.
12. Bodem JP, Schaal C, Kargus S, et al. Surgical management of bisphosphonate-related osteonecrosis of the jaw stages II and III. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, 2016, 121(4): 367 – 372.
17. 10. 2016
Print: LKS. 2016; 26(10): 221 – 226
Autoři:
Fotografie
- Archiv autorů
Rubrika:
Téma: