Klinický význam mikrobiologického testování v parodontologii
Přehledový článek
Souhrn: Článek se zabývá významem rutinní mikrobiologické analýzy zubního biofilmu pro léčbu parodontitidy. Autoři nabízejí různé pohledy na toto komplexní téma, ve kterém se protínají prvky mikrobiologické, patofyziologické a etiologické, s množnostmi využití analytických metod a rutinní parodontologické diagnostiky. Tradiční pohled na parodontální mikrobiom jako souhrn „bakteriálních komplexů“ vychází ze studií založených na kultivaci relativně malého množství bakterií. V současné době existují pokročilé metody mikrobiální analýzy využívající sekvenování nukleových kyselin, které významně rozšiřují a mění pohled na orální mikrobiom u parodontitidy. Spolu s aktuálním pojetím etiopatogeneze parodontitidy se proto mění náš pohled na klinický význam mikrobiologického testování a z části se odvrací od Socranského komplexů. Díky sekvenačním metodám dnes známe několik set bakterií souvisejících s parodontitidou. V klinické praxi se však využívá stále spíše levnějších metod vycházejících z kultivace malého počtu druhů, u nichž se předpokládá souvislost s onemocněním. Využití složitějších a nákladnějších metod je v běžné diagnostice zatím málo dostupné. Mezi parodontology nepanuje jednoznačný konsenzus ohledně využitelnosti poznatků mikrobiologického testování pro zlepšení klinického rozhodování, a tedy úspěšnosti lékařské péče. Cílem tohoto přehledového sdělení je přiblížit široké odborné veřejnosti z různých úhlů problematiku mikrobiálního testování v klinické parodontologické praxi.
Klíčová slova: mikrobiální testování, zubní plak, biofilm, orální mikrobiom, parodontitida
Clinical relevance of microbiological testing in periodontology
Narrative review
Summary: The review deals with importance of routine microbiological analysis of dental biofilm for clinical periodontology. Authors offer different points of view of this complex topic. Advanced PCR-based methods bring new insights and change our knowledge of periodontal aetiology and pathogenesis. Recent methods are able to detect hundreds of microbes with just one test, many of them otherwise uncultivable. In clinical practice, however, cheap and simple methods are used instead to analyse only few of the relevant bacterial taxa. Research in this field helps to identify disease-related, as well as health-related bacteria. That helps with our understanding of periodontitis and defining new therapeutic options. On the other hand, advanced methods are usually expensive and often unavailable, and their use in daily practice is still controversial. There is no consensus to date on interpretation of data obtained from microbiological assays, their prognostic or therapeutic value. The aim of this article is to elaborate on current knowledge and relevance of microbiological analysis for clinical periodontology.
Key words: microbiological analysis, periodontitis, dental plaque, biofilm, oral microbiome
Etiopatogeneze a mikrobiologie parodontitidy
Parodontitida je chronické zánětlivé onemocnění, biofilmem vyvolané a hostitelem zprostředkované, které postihuje závěsný aparát zubu. Na základě interakcí mezi biofilmem a hostitelem se nejprve rozvíjí gingivitida. Edém gingivy dává vznik anaerobnímu prostředí parodontální kapsy, kde se mění druhová pestrost i poměrné zastoupení mikroorganismů, jejich metabolismus a virulence. Vzrůstá zde celkové množství biofilmu a oportunní anaerobní druhy jsou četnější. Tento dysbiotický biofilm vyvolává zánětlivou reakci organismu, jejíž míra je individuálně ovlivňována imunitním systémem hostitele [2]. Při této reakci se mění tok sulkulární tekutiny, gradient kyslíku a živin, zvyšuje se přítomnost zánětlivých mediátorů i buněk v parodontální kapse i v okolních tkáních. Při progresi stavu do parodontitidy dochází prostřednictvím alterované reakce hostitele k resorpci alveolární kosti, prohlubování kapes, ústupu gingivy, purulentní exsudaci, krvácení jak spontánnímu, tak i na podnět, či bolesti. Je zřejmý reciproční vztah mezi reakcí hostitelského organismu a složením subgingiválního biofilmu [3 – 5].
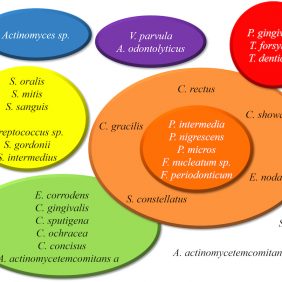
S rozvojem parodontitidy jsou spojovány zejména bakteriální druhy dříve klasifikované jako mikroorganismy „červeného komplexu“ (obr. 1) [6]. Ty jsou zároveň nejčastěji vyšetřované v rámci tradičního mikrobiálního testování a jejich přítomnost by měla svědčit pro horší prognózu onemocnění. Podle tohoto konceptu by bakterie „červeného komplexu“ měly být cílem antimikrobiální léčby. U některých těchto bakterií jsou však patogenní jen určité genotypy (např. JP2 genotyp Aggregatibacter actinomycetemcomitans – dále jen A. a.). Podobně je také u Porphyromonas gingivalis (dále jen P. g.) známá rozdílná virulence mezi jednotlivými poddruhy [7]. Za vyšší virulenci může být zodpovědných až několik set různých genů bakterie. Detekce virulentních variant bakterií je ale pomocí běžných analytických metod nemožná. Virulentní faktory v biofilmu se navíc často rozvíjejí až na základě vzájemných interakcí mezi bakteriemi [8]. Bakterie v biofilmu tak může mít jiné vlastnosti než stejná bakterie v jednodruhové kolonii, a tedy projev biofilmu není pouhým součtem vlastností jeho kolonizátorů.
Socranského komplexy
Tradiční mikrobiální testování v parodontologii vychází z práce kanadského parodontologa Sigmunda Socranského (1934–2011). V klíčové tezi o mikrobiálních komplexech subgingiválního biofilmu z 90. let minulého století vychází autor z dřívější (na kultivaci založené) identifikace 40 vybraných bakteriálních druhů. Sám pak sledoval jejich zastoupení u zdravých osob a pacientů s parodontitidou pomocí DNA-DNA hybridizace [1]. Zjistil přitom, že v parodontálních kapsách jsou některé kmeny četnější než ve zdravém sulku a vyskytují se často společně – jeden podmiňuje přítomnost druhého. Definoval tak několik „komplexů“ bakterií, které jsou při parodontitidě přítomny současně. Zatímco Socransky vycházel ze 40 druhů bakterií, my dnes, díky dostupnosti citlivějších diagnostických metod, víme přibližně o 770 druzích, které se podílejí na složení orálních biofilmů [5, 9]. Mnohé z těchto druhů nebyly v době Socranského objevů vůbec známé. Socransky identifikoval ty druhy, které se při parodontitidě vyskytují častěji. Z jeho práce ale nevyplývá, že by kterákoliv z těchto bakterií, ať už sama nebo v kombinaci, kauzálně vyvolávala parodontitidu.
Parodontitida není přenosné onemocnění
Parodontitidu nelze považovat za typické infekční onemocnění, jak ho definoval Robert Koch a popsal formou postulátů [10]. Žádná bakterie sama o sobě nevyvolá parodontitidu a každý z tzv. „parodontálních patogenů“ je nalézán i u zdravých jedinců [11]. Již sám Koch a jeho následovníci včetně Socranského navrhovali výjimky z těchto postulátů, zejména pro nemoci polymikrobiální, kde onemocnění vzniká na základě spolupráce více mikrobů, popř. v souhře s reakcí hostitele. Parodontitida je také popisována jako tzv. non-communicable disease, na jejímž rozvoji se mikrobiální agens významně podílí. Jde tedy o nepřenosné, plakem indukované, hostitelem zprostředkované, chronické zánětlivé onemocnění [4, 12].
Patogenita „patogenních“ druhů
Samotný koncept „patogenních“ bakteriálních druhů u parodontitidy se zdá být nepřesný. Z pojmu pathogenes vyplývá, že daný mikroorganismus vyvolává onemocnění. V případě parodontitidy se ale čím dál více mluví o roli alterované imunitní reakce, která umožní pomnožení oportunních bakterií a dovolí tak vzniknout dysbiotickému biofilmu, v němž začnou dominovat domnělé „patogeny“. Jde tedy stále o otázku, která dosud nebyla dostatečně zodpovězena: co bylo dříve – dysbiotická změna biofilmu, nebo alterovaná reakce hostitele? Gingivitidě předchází jednoznačně kumulace biofilmu.
Co se ale přechodu k parodontitidě týče, rozhodující je pravděpodobně obranná reakce organismu, edém gingivy a související zvětšení objemu a hloubky sulku, změna gradientu kyslíku a živin v subgingiválním prostoru a až následná změna složení biofilmu [3]. Tuto myšlenku podporují také experimenty, při kterých byl u experimentálně vyvolané parodontitidy odvrácen vznik dysbiózy pomocí systémové aplikace pro-resolučních mediátorů, což vedlo k omezení zánětlivé reakce [13]. Tedy díky ovlivnění alterované (hyperzánětlivé) odpovědi došlo k eliminaci zánětu a spontánnímu návratu k normálnímu eubiotickému složení biofilmu – zcela bez antibiotik i bez odstranění zubního plaku.
Nespecifita parodontálních patogenů
Tradiční domnělé „patogeny“ parodontitidy (viz obr. 1) se tedy, jak už bylo zmíněno, běžně vyskytují také u zdravých pacientů, ačkoli obvykle v menší míře [14]. Samotná P. g. je u parodontitidy s chronickým průběhem přítomná jen v 54 % případů, ostatní bakterie jsou prokazovány ještě vzácněji [11]. Některé druhy, jako A. a., jsou častěji nacházeny u agresivního fenotypu parodontitidy. Ani to ale není patognomické pro tuto formu parodontitidy, neboť A. a. se vyskytuje četně jak u pacientů s chronickým fenotypem parodontitidy, tak také u pacientů bez parodontitidy [15]. To je zohledněno rovněž v platné klasifikaci parodontopatií [16], která agresivní fenotyp nevyděluje z obecné definice parodontitidy.
Nebakteriální osídlení
Nedoceněná a opomíjená je role nebakteriálních kolonizátorů zubního biofilmu. Viry a jejich synergie s bakteriemi mohou v rozvoji parodontitidy hrát také významnou roli [11]. V parodontálních kapsách byly detektovány herpesviry, papillomaviry, HIV, EBV nebo CMV [17], rovněž pak někteří prvoci, kvasinky či metanogenní archaea [18]. Jejich analýza je sice možná, ale nákladná. Celková masa nebakteriálních druhů je menší než 5 %, některé druhy archaeí však plní v subgingiválním biofilmu nezanedbatelné metabolické role [19].
Možnosti mikrobiologické analýzy
Mikrobiální testování je v zubním lékařství rozšířeným a široce využívaným nástrojem. Největší roli dnes hraje v orální medicíně, parodontologii a kariologii. K analýze složení zubního biofilmu je možno využít mnoha metod. Komerční testy dostupné v České republice, využitelné pro kariologické a parodontologické účely, byly přehledně popsány v LKS v čísle 2/2019 [20].
Základní metodou detekce mikroorganismů je kultivace na selektivních médiích. Mnohé z dnes známých druhů parodontálních „patogenů“ jsou ale nekultivovatelné a obecně je kultivace anaerobních druhů velmi náročná. Mezi další možnosti pak patří imunochromatografická detekce antigenu, tedy využití reakce mezi obarvenou protilátkou a charakteristickým bakteriálním znakem, nebo detekce organismu pomocí analýzy hmotnostního spektra bílkovin (např. metodou MALDI-TOF) [21].
Pro současnou klinickou parodontologii má velký přínos sekvenování DNA mikroorganismů, dříve založené na polymerázové řetězové reakci (angl. polymerase chain reaction, PCR), dnes nejvíce využívající metod sekvenování dalších generací (next-generation sequencing, NGS). Metody založené na PCR využívají specifické sondy připravené podle DNA známých bakterií – jsou tedy sice vysoce specifické a senzitivní, ale neodhalí neznámé druhy. Oproti tomu metody NGS nevyžadují předchozí znalost organismu. Různými způsoby detekují průběh polymerizace různých částí DNA a získaná sekvence je pak srovnána s databází. Velmi užitečné je sekvenování genu pro 16S rRNA [22].
Analýza genu pro 16S rRNA a její význam v parodontologii
Analýza 16S rRNA je založená na sekvenaci segmentu DNA organismu, která obsahuje gen pro malou podjednotku ribozomální RNA metodami NGS. Tato část genetické informace je na jednu stranu univerzální napříč prokaryotními organismy – tedy vyskytuje se v této podobě u všech druhů, ale zároveň obsahuje i velmi variabilní oblasti, které jsou pro konkrétní druhy jedinečné [23, 24]. Díky této metodě byly popsány i nekultivovatelné organismy, včetně těch osidlujících zubní biofilmy. V současnosti je známo více než 770 mikrobiálních druhů, které se podílejí na složení orálních biofilmů [9, 25].
V kombinaci s mikročipy jsou tyto metody schopny detekovat i několik set bakteriálních druhů současně; a tak lze srovnávat celé mikrobiomy mezi sebou. Tyto metody jsou nákladné a v řadě běžných laboratoří nedostupné. Díky nim však lze hodnotit složení biofilmu jako celku – jako klastr několika set bakterií, které s parodontální dysbiózou buď souvisejí, nebo nesouvisejí, podle společného výskytu a specifického poměru mezi nimi [26]. Ani biofilm se vzorcem typickým pro parodontitidu však nemusí být stejně patogenní pro každého jedince, jelikož u každého člověka je imunitní odpověď jiná a pro něj jedinečná [24]. Složení biofilmu reaguje na tuto imunitní odpověď a ta upravuje své mechanismy podle dynamicky se měnících vlastností biofilmu. Jedná se o reciproční vztah mezi hostitelem a biofilmem.
Klinický význam mikrobiálního testování
Mikrobiální testy jsou v klinické parodontologii nejčastěji využívány k odhadu rizika vzniku parodontitidy, posouzení prognózy léčby a jako pomocný nástroj při volbě antibiotické medikace. K tomu jsou v českém prostředí k dispozici komerční testy založené na PCR (DNA-DNA hybridizace) nebo analýze genu pro 16S rRNA [20], které ale detekují pouze několik bakteriálních druhů vybraných na základě překonaných Socranského komplexů. Některé takové testy jsou doplněny semikvantitativním hodnocením množství analyzovaných druhů a antibiogramem.
Riziko vzniku parodontitidy a prognóza léčby
Obecně lze rizikové faktory pro vznik parodontitidy dělit na neovlivnitelné a ovlivnitelné. Mezi ty první patří vrozená geneticky daná vnímavost organismu a systémová onemocnění. Ovlivnitelnými faktory pak jsou výživa, fyzická aktivita, kouření a samozřejmě dentální hygiena [27]. Rozvoj parodontitidy závisí na různé odpovědi organismu na mikrobiální zátěž představovanou zubním biofilmem. Samotný mikrobiologický profil přitom není rizikovým faktorem pro vznik parodontitidy.
Vlastnosti biofilmu jako celku jsou více než jen součet vlastností jeho kolonizátorů. Proto nemá klinický význam hodnotit jeho virulenci podle výskytu konkrétních bakteriálních kmenů v biofilmu, ani hledat virulentní faktory v jejich genetickém kódu. U mnoha druhů jsou navíc vysoce virulentní jen některé genotypy.
Parodontitida není přenosným onemocněním. Dva jedinci s totožným mikrobiálním profilem mohou mít odlišný stav parodontu. Sledování výskytu malého množství domnělých parodontálních „patogenů“ neodpovídá komplexitě biofilmu a nemá tak klinický význam u parodontologických pacientů, ani jejich partnerů či příbuzných. Přítomnost žádného z tradičně sledovaných druhů (obr. 1) ani jejich souvýskyt neznamená sám o sobě zvýšené riziko parodontitidy ani nutnost léčby a už vůbec horší prognózu. O prognóze léčby pak, lépe než mikrobiologické testování, vypovídá stanovení gradingu podle aktuální klasifikace a hodnocení odpovědi na léčbu [16, 28].
Pokud by mikrobiální testování mělo sloužit k potvrzení parodontitidy, pak ta je snadno prokazatelná klinicky (sondáž, furkace, viklavost, krvácení po sondáži) a rentgenologicky (resorpce alveolární kosti). Diagnóza parodontitidy ani prognóza její léčby se na mikrobiálním statutu nezakládá [28, 29].
Volba antibiotické medikace
Parodontolog se mikrobiologa nejčastěji dotazuje, jaké antibiotikum použít ke zlepšení výsledků nechirurgické léčby. V praxi se pak tato otázka zúžila na rozhodnutí, zda použít nebo nepoužít v kombinaci s metronidazolem i amoxicilin, který by měl být cílen na A. a. Tento fakultativní anaerob se však vyskytuje běžně i u zdravých pacientů [11] a v českém prostředí dostupné komerční diagnostické testy (příklad v tab. 1) nemají schopnost rozlišit jeho vysoce virulentní genotyp [30]. Tyto testy navíc identifikují nejvýše 11 bakteriálních druhů, ignorují nebakteriální mikroorganismy, a poskytují tak velmi omezený obraz o mikrobiálním profilu subgingiválního biofilmu u pacienta s parodontitidou [20].
Volbu antibiotické medikace tedy nelze založit na běžných mikrobiologických testech. Parodontální kapsy kolonizují mikroorganismy zejména anaerobní, v malé míře pak také aerobní. Cílem antibiotické léčby v parodontologii je aktuálně spíše kvantitativní potlačení mikrobiomu v celém jeho spektru než eliminace konkrétních druhů. Volba systémově podané antimikrobiální látky jako adjuvans během nechirurgické nebo chirurgické fáze léčby pak vychází ze zhodnocení rizik a benefitů takové medikace a z klinických studií [31, 32].
Závěr
Na základě zmíněných argumentů se dá říct, že v klinické parodontologii není aktuálně opodstatněné využívání rutinního mikrobiologického testování, a to v žádné fázi léčby. Analýza malého množství vybraných „patogenů“ ani celých mikrobiálních klastrů v biofilmu neodpovídá současnému pohledu na etiopatogenezi parodontitidy. Metody starší ani nové nepřinášejí dosud informace, které by jednoznačně napomáhaly k identifikaci vyššího rizika parodontitidy, zlepšovaly odhad prognózy léčby, nebo by ovlivnily rozhodování lékaře o léčebném postupu. Autorům tedy nejsou známy důkazy o tom, že by mikrobiální testování zlepšovalo výsledky parodontologické léčby. Rozhodnutí se zakládají zejména na empirických znalostech a klinických studiích [31, 33].
Nejde přitom o ojedinělý závěr [14, 34]. Autoři recentní učebnice parodontologie [28], za kterou stojí Italská parodontologická společnost, uzavírají kapitolu o mikrobiálním testování slovy: „...Mikrobiologické testování může být nápomocné v diagnostice výhradně jako doplněk k potvrzení zvláštního typu parodontitidy, již však prokázaného klinickým a rentgenologickým vyšetřením.“ (překlad autora). Dále pak Nibali v nedávném článku uvádí, že mikrobiální testování nelze doporučit jako kritérium pro předpis adjuvantních antibiotik [35]. Ještě silnější mandát mají Evropská a Americká parodontologická asociace (EFP a AAP), které společně v roce 2017 vytvořily aktuální klasifikaci parodontálních onemocnění [16]. Mikrobiologický profil vůbec není zahrnut do stagingu nebo gradingu parodontitidy. EFP a AAP tedy nepovažují mikrobiální testování za významné pro odhad progrese či prognózy, ani pro popis komplexity či rozsahu parodontitidy, nedávají mu žádnou roli v klinickém rozhodování.
Zkoumání složení zubního biofilmu zůstává velmi zajímavou a přínosnou oblastí medicíny. Moderní analytické metody přispívají k pochopení etiopatogeneze parodontitidy. Pro další rozvoj parodontologie je stěžejní objasnění dynamiky supra- i subgingiválního biofilmu, pochopení mechanismů odpovědných za posun ze symbiotického k dysbiotickému stavu a zkoumání kooperace mezi bakteriemi a hostitelem i mezi bakteriemi, příp. viry a kvasinkami navzájem [26]. Není tak vyloučeno, že v budoucnu opět mikrobiální testování nabude na významu pro klinickou parodontologii a bude hrát pomocnou roli v plánování léčby nebo hodnocení jejího průběhu [36].
Přetrvávají nezodpovězené otázky a složitost problematiky se stále prohlubuje. Současný parodontologický výzkum se soustředí zejména na faktory hostitele, které ovlivňují jak riziko rozvoje onemocnění, tak i prognózu léčby. Pohled na etiologii a léčbu parodontopatií se vyvíjí v závislosti na poznatcích z oblasti imunologie, mikrobiologie, diagnostiky, a také na vývoji holistických analytických metod integrujících faktory environmentální a mikrobiologické se stavem hostitelského organismu [37].
Poděkování: Autoři děkují prof. MUDr. Lydii Izakovičové Hollé, Ph.D., a MDDr. Radovanu Žižkovi, Ph.D., za odbornou revizi a kritické připomínky.
Prohlášení: Autoři negují konflikt zájmů či jakoukoli vazbu na osoby zabývající se výrobou a distribucí uvedených produktů nebo jim podobných.
Obrazová dokumentace

Literatura
1. Socransky SS, Haffajee AD, Cugini MA, Smith C, Kent RL. Microbial complexes in subgingival plaque. J Clin Periodontol. 1998; 25: 134 – 144.
2. Herrera D, Retamal-Valdes B, Alonso B, Feres M. Acute periodontal lesions (periodontal abscesses and necrotizing periodontal diseases) and endo-periodontal lesions. J Clin Periodontol. 2018; 45: S78-S94.
3. Van Dyke TE, Sima C. Understanding resolution of inflammation in periodontal diseases: Is chronic inflammatory periodontitis a failure to resolve? Periodontol 2000. 2020; 82: 205 – 213.
4. Van Dyke TE, Bartold P, Reynolds E. The Nexus Between Periodontal Inflammation and Dysbiosis. Front Immunol. 2020; 11: 511.
5. Curtis MA, Diaz PI, Van Dyke TE. The role of the microbiota in periodontal disease. Periodontol 2000. 2020; 83: 14 – 25.
6. Haffajee AD, Socransky SS. Microbial etiological agents of destructive periodontal diseases. Periodontol 2000. 1994; 5: 78 – 111.
7. Lang NP, Lindhe J, Berglundh T, et al. Clinical periodontology and implant dentistry. 6. vydání. New York: Wiley-Blackwell; 2015, 207.
8. Filoche S, Wong L, Sissons CH. Oral Biofilms: Emerging concepts in microbial ecology. J Dent Res. 2010; 89: 8 – 18.
9. Chen T, Yu W-H, Izard J, Baranova OV, Lakshmanan A, Dewhirst FE. The Human Oral Microbiome Database: a web accessible resource for investigating oral microbe taxonomic and genomic information. 2022. [cit. 24. 8. 2022]. Dostupné z: https://www.homd.org
10. Koch R. Die Ätiologie der Tuberkulose. Mittheilungen aus dem Kaiserlichen Gesundheitsamte. 1884; 2: 428 – 445.
11. Newman MG, Takei HH, Klokkevold PR, et al. Carranza’s clinical periodontology. 12. vydání. Filadelfie: Saunders; 2014, 152, 161 – 162
12. Niklander S, Bordagaray MJ, Fernández A, Hernández M. Vascular endothelial growth factor: a translational view in oral non-communicable diseases. Biomolecules. 2021; 11: 85.
13. Lee C-T, Teles R, Kantarci A, Chen T, McCafferty J, Starr JR, Brito LCN, Paster BJ, Van Dyke TE. Resolvin E1 reverses experimental periodontitis and dysbiosis. J Immunol. 2016; 197: 2796 – 2806.
14. Loomer PM. Microbiological diagnostic testing in the treatment of periodontal diseases. Periodontol 2000. 2004; 34: 49 – 56.
15. Mombelli A, Casagni F, Madianos PN. Can presence or absence of periodontal pathogens distinguish between subjects with chronic and aggressive periodontitis? A systematic review. J Clin Periodontol. 2002; 29: 10 – 21.
16. Caton J, Armitage G, Berglundh T, Chapple I, Jepsen S, Kornman K, Mealey B, Papapanou P, Sanz M, Tonetti M. A new classification scheme for periodontal and peri-implant diseases and conditions – Introduction and key changes from the 1999 classification. J Periodontol. 2018; 89: S1 – S8.
17. Slots J. Oral viral infections of adults. Periodontol 2000. 2009; 49: 60 – 86.
18. Matarazzo F, Ribeiro AC, Feres M, Faveri M, Mayer MPA. Diversity and quantitative analysis of Archaea in aggressive periodontitis and periodontally healthy subjects. J Clin Periodontol. 2011; 38: 621 – 627.
19. Dabdoub SM, Ganesan SM, Kumar PS. Comparative metagenomics reveals taxonomically idiosyncratic yet functionally congruent communities in periodontitis. Sci Rep. 2016; 6: 38993.
20. Bořilová Linhartová P, Kavříková D, Slezáková S, Kukletová M, Izakovičová Hollá L. Komerční testy pro stanovení rizika rozvoje zubního kazu a onemocnění parodontu. LKS. 2019; 29(2): 30 – 37.
21. Wei Y-S, Chang Y-R, Tsai Y-T, Yang Y-T, Weng S-H, Tseng L-F, Chou H-C, Hu AT, Liao E-C, Chen H-Y, Lin G-Y, Cheng W-C, Chan H-L. The distribution of cultivable oral anaerobic microbiota identified by MALDI-TOF MS in healthy subjects and in patients with periodontal disease. J Pharm Biomed Anal. 2021; 192: 113647.
22. Gupta N. Next-generation sequencing and its application: empowering in public health beyond reality. In: Arora PK (Ed). Microbial technology for the welfare of society. Singapur: Springer; 2019: 313–341.
23. Clarridge JE. Impact of 16S rRNA gene sequence analysis for identification of bacteria on clinical microbiology and infectious diseases. Clin Microbiol Rev. 2004; 17: 840 – 862.
24. Janda JM, Abbott SL. 16S rRNA gene sequencing for bacterial identification in the diagnostic laboratory: pluses, perils, and pitfalls. J Clin Microbiol. 2007; 45: 2761 – 2764.
25. Abdullah N, Al-Marzooq F, Mohamad S, Abd Rahman, N, Chi Ngo H, Perera Samanayake L. Intraoral appliances for in situ oral biofilm growth: a systematic review. J Oral Microbiol. 2019; 11: 1647757.
26. Bizzarro S, Buijs MJ, Crielaard W, Loos BG, Zaura E, Laine ML, Brandt BW. Microbial profiles at baseline and not the use of antibiotics determine the clinical outcome of the treatment of chronic periodontitis. Sci Rep. 2016; 6: 20205.
27. Martinon P, Fraticelli L, Giboreau A, Dussart C, Bourgeois D, Carrouel F. Nutrition as a key modifiable factor for periodontitis and main chronic diseases. J Clin Med. 2021; 10: 197.
28. Carrassi A, Cortellini P, Trombelli L (Eds). Atlas of periodontology and implant therapy. 1. vydání. Berlín: Quintessence Publishing; 2019, 76.
29. Chapple ILC, Mealey BL, Van Dyke TE, Bartold PM, Dommisch H, Eickholz P, Geisinger ML, Genco RJ, Glogauer M, Goldstein M, Griffin TJ, Holmstrup P, Johnson GK, Kapila Y, Lang NP, Meyle J, Murakami S, Plemons J, Romito GA, Shapira L, Tatakis DN, Teughels W, Trombelli L, Walter C, Wimmer G, Xenoudi P, Yoshie H. Periodontal health and gingival diseases and conditions on an intact and a reduced periodontium: Consensus report of workgroup 1 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Periodontol. 2018; 89 Suppl 1: S74-S84.
30. Smola SF, Dřízhal I, Burýšek L. VariOr-Dento test v mikrobiologické diagnostice a kontrole léčení parodontitid a periimplantitid. GenTrend; 2001. Dostupné z: https://www.gentrend.cz/cs/sluzby/diagnostika-ve-stomatologii/varior-r-dento-dna-diagnostika-parodontitid-a-periimplantitid
31. Keestra JAJ, Grosjean I, Coucke W, Quirynen M, Teughels W. Non-surgical periodontal therapy with systemic antibiotics in patients with untreated chronic periodontitis: a systematic review and meta-analysis. J Periodontal Res. 2015; 50: 294 – 314.
32. Kilian M. The oral microbiome – friend or foe? Eur J Oral Sci. 2018; 126 Suppl 1: 5 – 12.
33. Borges I, Faveri M, Figueiredo LC, Duarte PM, Retamal-Valdes B, Montenegro SCL, Feres M. Different antibiotic protocols in the treatment of severe chronic periodontitis: A 1-year randomized trial. J Clin Periodontol. 2017; 44: 822 – 832.
34. Vrijghem C, Cosyn J, Fransen J, Christiaens V. A questionnaire-based crossover study on the association of microbiological testing with prescription of systemic antibiotics following initial periodontal therapy. J Clin Periodontol. 2021; 48: 618 – 626.
35. Nibali L, Koidou VP, Hamborg T, Donos N. Empirical or microbiologically guided systemic antimicrobials as adjuncts to non-surgical periodontal therapy? A systematic review. J Clin Periodontol. 2019; 46: 999 – 1012.
36. Myšák J, Podzimek Š, Janatová T, Dušková J, Janata J, Najmanová L. Změny orálního mikrobiomu v průběhu nechirurgické terapie pacientů s pokročilou parodontitidou. Čes stomatol Prakt zubní lék. 2021; 121(3): 67 – 74.
37. Sima C, Van Dyke TE. Systems medicine and periodontal diseases. In: Sonis ST, Villa A (Eds). Translational systems medicine and oral disease. Londýn: Academic Press; 2020: 249 – 282.
15. 10. 2022
Print: LKS. 2022; 32(10): 168 – 173
Autoři:
Rubrika:
Téma: