Komerční testy pro stanovení rizika rozvoje zubního kazu a onemocnění parodontu
Přehledové sdělení
Souhrn: Přehledový článek popisuje výhody a nevýhody testů aktuálně dostupných na českém trhu (případně v EU), které jsou zubním lékařům nabízeny k diagnostice zubního kazu a/nebo onemocnění parodontu u dětí i dospělých, k výběru optimálních terapeutických postupů i k ověření efektivity léčby. Testování mohou být prováděna přímo v ordinaci zubního lékaře nebo v externí laboratoři a hodnotí se nejčastěji množství a kvalita sliny, počet vybraných kariogenních a/nebo parodontálních bakterií, případně geneticky podmíněná predispozice pacienta (variabilita v genu pro prozánětlivý cytokin interleukin-1). Existuje několik variant kitů s různou citlivostí a přesností; některé z nich však vyžadují další přístrojové vybavení. V rámci posílení prevence a orální péče mohou být některé testy pro určení individuální náchylnosti k těmto chorobám účinným nástrojem při behaviorální intervenci nejenom u pacientů s rizikovým nálezem.
Klíčová slova: test, slina, orální mikroflóra, prevence, parodontitida, zubní kaz
Commercial tests for the determination of dental caries and periodontal disease risk and development
Review article
Summary: The review describes the advantages and disadvantages of commercial tests currently available to dentists on the Czech (or EU) market for diagnosing the dental caries and/or periodontal disease in children and adults, for selection of optimal therapeutic procedures and for veryfying of the treatment efficiency. These tests are intended for dental practice; testing can be performed directly in the dentist’s office or in an external laboratory. The saliva quantity and quality, the number of selected cariogenic and/or periodontal bacteria, or the genetic predisposition of the patient (variability in the proinflammatory cytokine interleukin-1 gene) are evaluated. Several variants of kits with different sensitivity and accuracy are available; some of them require additional instrumentation. In the context of strengthening prevention and oral care, several tests for the determination of the individual susceptibility to these diseases can be an effective tool in behavioral intervention not only in patients with risk finding.
Key words: test, saliva, oral microflora, prevention, periodontitis, dental caries
Úvod
Onemocnění dutiny ústní u dětí i dospělých jsou aktuálním problémem současné medicíny, proto existuje intenzivní snaha o co nejpřesnější a nejjednodušší diagnostiku jejich etiologie, stanovení optimálního léčebného plánu dle individuálního nálezu a současně o posílení preventivních opatření pomocí behaviorální intervence. Nejčastěji pacienti trpí zubním kazem a/nebo onemocněním závěsného aparátu zubů (1), kdy v etiopatogenezi obou těchto multifaktoriálních onemocnění hrají roli orální bakterie a schopnost organizmu se s jejich přítomností vyrovnat bez poškození vlastních tkání.
Protektivní roli sehrává slina, která svým tokem odplavuje zbytky potravy z dutiny ústní a ovlivňuje složení orální mikroflóry. Současně slina obsahuje proteiny s různou funkcí (imunoprotektivní, antimikrobiální, pufrovací atd.) a ionty. Pufrovací systémy, které neutralizují kyselé prostředí v dutině ústní, jsou tři: fosfátový, bílkovinný a bikarbonátový (hydrogenuhličitanový). pH v ústech je ovlivňováno nejenom složením stravy a nápojů (sladkosti, kyselé nápoje apod.), ale také užíváním léčiv (např. inhalační kortikosteroidy) (2), regurgitací kyselého obsahu žaludku do dutiny ústní a/nebo celkovým zdravotním stavem pacienta.
Při vzniku a rozvoji zubního kazu hraje úlohu častá a/nebo nadměrná spotřeba sacharidů (zejména sacharózy) a přítomnost grampozitivního fakultativního anaeroba Streptococcus mutans a dalších kariogenních bakterií (Lactobacillus sp., Actinomyces sp.) (3), které jsou schopny metabolizovat fermentovatelné sacharidy za vzniku organických kyselin zodpovědných za demineralizaci skloviny. Zubní kaz postihuje dočasnou i stálou dentici a orální bakteriální profil je závislý nejenom na typu dentice, ale i na rozsahu kariézního procesu (4).
Jelikož bakterie schopné vyvolat onemocnění soutěží s běžnými orálními symbiotickými druhy v dutině ústní, vede jejich pomnožení k narušení rovnováhy a ke změně složení orálního biofilmu, k tzv. dysbióze. Dysbiotický stav v dutině ústní může vést také k onemocnění závěsného aparátu zubu, jedná se převážně o polymikrobiální infekci, avšak bez jednoznačné spojitosti se specifickou bakterií/bakteriemi. Nejčastěji jsou u pacientů s parodontitidou detekovány gramnegativní anaeroby červeného komplexu (Porphyromonas gingivalis, Tannerella forsythia, Treponema denticola) a oranžového komplexu (Fusobacterium nucleatum, Parvimonas micra, Prevotella intermedia, Campylobacter rectus) (5, 6). Z přehledu současné literatury nevyplynuly žádné kvalitativní rozdíly ve složení orálního mikrobiomu mezi pacienty s agresivní (AgP) a s chronickou parodontitidou (CP) (7). Aggregatibacter actinomycetemcomitans je sice spojován se zvýšeným rizikem lokalizované AgP (8), především přítomnost vysoce virulentního klonu JP2 v subgingiválním prostoru může sloužit při predikci vzniku a progrese onemocnění, bývá však prokazován pouze u určité malé podskupiny pacientů (9).
Mombelli (10) ve své práci píše, že v současné době neexistuje pro léčbu jakékoliv formy onemocnění parodontu protokol s prokazatelnou nadřazeností, na druhou stranu existují i studie navrhující konkrétní účinné látky nebo postupy pro léčbu pacientů se specifickým mikrobiálním profilem (11, 12). Pokud u pacientů budou definovány klíčové rizikové bakteriální druhy, je možné individuálně přistoupit k jejich eradikaci/potlačení a současně umožnit rekolonizaci příznivé a zdravé flóry, ať už konvenčními metodami, nebo novými biotechnologickými přístupy (13).
Ačkoliv se na výzkumném poli hledají genetické markery určující individuální náchylnost jedince k zubnímu kazu i k parodontitidě, výsledky studií jsou často protichůdné a závislé nejenom na typu dentice, ale liší se také mezi různými populacemi. V současné době je variabilita v genu kódujícím prozánětlivý cytokin interleukin-1 (IL-1) považována za jeden z možných faktorů ovlivňujících vznik a rozvoj parodontitidy (14). V naší nedávné studii (15) jsme však u pacientů v české populaci zjistili, že ti s T alelou v místě +3953C/T (rs1143634) v sekvenci IL-1beta genu mají menší riziko rozvoje CP; různé haplotypy (kombinace alel) v IL-1 genovém klasteru mohou ovlivňovat také riziko rozvoje CP u pacientů s/bez diabetes mellitus.
Cíl a metodika analýzy trhu
Cílem přehledového článku bylo shrnout informace o komerčních testech dostupných na českém trhu (eventuálně v EU), které jsou doporučeny k využití ve stomatologii/zubním lékařství. Při analýze trhu jsme postupovali tak, že jsme oslovili firmy nabízející produkty nebo služby v oblasti dentální diagnostiky a vyžádali jsme si od nich nezávazné nabídky a podrobné informace ke komerčním kitům pro testování sliny, orální mikroflóry a/nebo vrozené náchylnosti k zánětlivým onemocněním. Firmy jsme vybrali na základě osobní zkušenosti, doporučení kolegů praktických zubních lékařů a parodontologů, nebo s využitím internetových vyhledávačů.
Komerční testy pro stanovení vlastností sliny
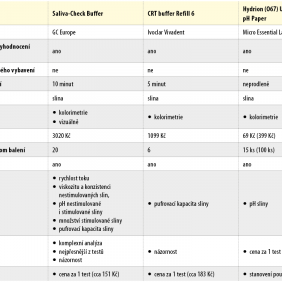
Testování sliny lze využít v řadě klinických situací, ať už u pacientů s dentinovou hypersensitivitou, s onemocněním slinných žláz (xerostomie, Sjögrenův syndrom), při posouzení rizika vzniku a rozvoje zubního kazu i parodontitidy. Na druhou stranu je však třeba poznamenat, že měření vlastností sliny se nejeví jako vhodný nástroj pro hodnocení rizika vzniku atrice/abraze (16). Přehled testů pro analýzu sliny a jejich specifikace jsou uvedeny v tab. I, kde jsme kromě testů zjišťujících pufrovací kapacitu sliny (CRT buffer Refill 6, Ivoclar Vivadent) a případně i další parametry (Saliva-Check Buffer, GC Europe) zahrnuli také testovací proužky pro určení pH sliny (Hydrion (O67) Urine & Saliva pH Paper, Micro Essential Laboratory, Inc.). Testování pH sliny je založeno na principu kolorimetrické reakce, kdy pomocí barevného indikátoru můžeme identifikovat pH sliny, a to v rozmezí 5,5 až 8,0. Obdobně je stanovována i pufrovací kapacita sliny, která je určena z třístupňové škály: nízká, střední, vysoká.
Ve srovnávacích studiích hodnotících korelaci mezi kolorimetrickými testy typu strip (CRT buffer Refill 6, Ivoclar Vivadent a Saliva-Check Buffer, GC Europe) a laboratorními metodami pro analýzu pufrovací kapacity slin bylo zjištěno, že test Saliva Check Buffer (GC Europe) je přesnější než test CRT Buffer Refill 6 (Ivoclar Vivadent) (17, 18), pomocí testu Saliva Check Buffer (GC Europe) lze stanovit vícero parametrů (rychlost toku, viskozitu a konzistenci nestimulovaných slin, pH pacientovy klidové i stimulované sliny a její množství); navíc je i levnější.
Obecně lze říci, že testování sliny k určení míry rizika vzniku zubního kazu a parodontitidy je založeno na jednoduchých principech a provedení, které je možno zvládnout v čase do 10 minut. Ke všem uvedeným testům je přiložen český návod, není potřeba dalšího přístrojového vybavení a provedení testu je proto možné přímo v ordinaci zubního lékaře nebo dentální hygienistky. Kritickým momentem je vlastní odběr sliny (stimulované i nestimulované), kdy pacient nesmí 1 hodinu před odběrem jíst, žvýkat žvýkačku, kouřit, čistit si zuby a používat ústní vodu, pít by měl pouze čistou vodu. Odečet výsledku je nenáročný a velmi názorný, především pak po předložení výsledku pacientovi může být toto testování vhodným nástrojem pro intervenční proces. Rozhodující pro výběr ideálního testu pro konkrétního pacienta tedy bude cena a/nebo komplexnost výsledku.
Komerční testy pro stanovení orálních mikroorganizmů
Determinace vybraných mikroorganizmů osidlujících dutinu ústní je založena na několika základních principech, a to na kultivaci bakterií na selektivních médiích, na imunochromatografické detekci antigenu nebo na identifikaci specifické sekvence genu pro malou podjednotku ribozomální RNA (16S rRNA) pomocí metod využívajících polymerázovou řetězovou reakci (PCR). PCR se již stala standardním diagnostickým a výzkumným nástrojem v parodontologii, jelikož její citlivost a specifičnost umožňuje rychlou a účinnou metodu detekce, identifikace a kvantifikace mikroorganizmů i stanovení genetického profilu pacienta (19).
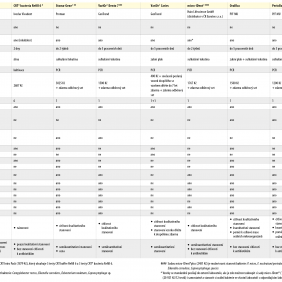
Přítomnost kariogenních bakterií lze zjistit pomocí testu CRT® bacteria Refill 6 (Ivoclar Vivadent) založeného na kultivaci nebo pomocí imunochromatografického testu Saliva-Check Mutans (GC Europe), viz tab. II. Oba testy jsou ekonomicky stejně náročné (cca 450 Kč na 1 test) a vstupním vzorkem je slina pacienta. Test Saliva-Check Mutans (GC Europe) určený pro analýzu S. mutans nevyžaduje další přístrojové vybavení a výsledek je znám do 15 minut, zatímco test CRT® bacteria Refill 6 (Ivoclar Vivadent) pro stanovení S. mutans a Lactobacillus sp. vyžaduje kultivaci vzorku při teplotě 37 °C po dobu 2 dnů. Je možné využít i produkt CRT Intro Pack (Ivoclar Vivadent), který obsahuje testy CRT Buffer Refill 6 a CRT® bacteria Refill 6.
Pro stanovení vícero kariogenních a/nebo parodontálních bakterií lze využít několika komerčních testů. Protože jsou založeny na PCR, je nezbytné použít termocykler a jejich provedení tedy není možné v běžné zubní ordinaci, viz tab. II. Vzhledem k vysoké variabilitě bakteriálních genomů je možné, že některé subtypy nemusí být možné těmito testy stanovit.
V České republice lze kontaktovat firmy Protean, GenTrend, HAIN LIFESCIENCE GmbH (distributor v ČR Eurotex, s. r. o.) nebo PřF MU, které analýzu vybraných bakterií nabízejí formou služby. Pro stanovení mikroorganizmů z parodontálního sulku je možné oslovit také firmy v Německu – Carpegen GmbH (test Carpegen® Perio Diagnostik, dříve Meridol® Diagnostik) nebo ve Švýcarsku – IAI AG (iai PadoTest). Italská firma Saccace Biotechnologies pak nabízí k zakoupení sadu (PeriodontScreen Real-TM, v ČR distribuováno firmou Dynex), s jejíž pomocí si ve vlastní laboratoři s odpovídajícím laboratorním vybavením lze vybrané orální mikroorganizmy vyšetřit (obdobně lze zakoupit i sady od HAIN LIFESCIENCE GmbH).
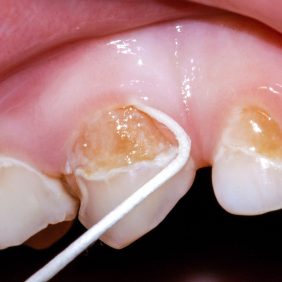
Ke stanovení je třeba, aby byl odebrán vzorek sulkulární tekutiny a/nebo zubního plaku a přiložena žádanka s identifikací pacienta a lokalizace zubu, ze kterého byl vzorek odebrán. Odběr vzorku se provádí pomocí papírového čepu (ISO 40 nebo 50) ze zubu s největším zánětem, viz obr. 1. Nejenom při porovnání výsledků před a po terapii je nutné dodržovat standardizovaný postup odběru, který je uveden v návodu, a používat stejný typ testu. Z externí laboratoře jsou výsledky vyšetření často i s doporučením vhodné antibiotické léčby doručeny nejpozději do 14 dnů.
Kvalitativní analýza je možná při použití všech metodických přístupů, rozdíl je však v možnosti determinace počtu druhů v jedné reakci a v přesnosti (citlivosti) kvantitativního stanovení. Z tohoto úhlu pohledu se jeví molekulárně biologický přístup, konkrétně multiplexová PCR v reálném čase, jako nejvýhodnější, jelikož umožňuje stanovení vícero bakteriálních druhů v jedné reakci a současně poskytuje i informaci o jejich počtu ve vzorku, a to i v procentuálním zastoupení vůči celkovému mikrobiomu (testy od PřF MU). Na základě komplexního mikrobiologického vyšetření lze poté lépe určit míru rizika resorpce závěsného aparátu zubu a kosti nebo zubního kazu. Současně lze tyto testy využít i k analýze bakteriálních komplikací po implantologické léčbě.
Při nálezu určitých parodontálních bakterií ve vyšším počtu je nejvhodnějším postupem odeslat pacienta na specializované pracoviště, kde parodontolog provede detailní klinické i mikrobiologické vyšetření, na jehož základě poté zvolí odpovídající terapii. Navíc parodontolog může při určitých stavech (diagnózy K052, K053, K055, K056) vykázat mikrobiologické vyšetření k úhradě některým zdravotním pojišťovnám (např. VZP), což není v kompetenci praktického zubního lékaře. Uvedené testy se stanovením založeným na principu PCR se používají nejenom v klinické praxi, ale zatím zejména při výzkumu etiopatogeneze onemocnění dutiny ústní (20, 21, 22).
Přínosem testování mikrobiálního profilu pacienta by bylo, pokud by testy odhalily také případnou rezistenci bakterií ke konkrétním antibiotikům. Ačkoliv některé firmy (Protean a GenTrend) průkaz rezistence k beta-laktamovým antibiotikům nabízejí, je nutné poznamenat, že je toto založeno na analýze genů kódujících betalaktamázy v DNA (chromozomální, plazmidová, transpozonová). Pro přesné určení, zda je gen pro betalaktamázu exprimován a bakterie je tedy rezistentní k beta-laktamovým antibiotikům, by měla být provedena i analýza fenotypu (23).
Komerční testy pro stanovení vrozené náchylnosti k onemocněním dutiny ústní
Testování vrozené náchylnosti k onemocnění závěsného aparátu zubu je v současnosti na evropském trhu nabízeno formou analýzy IL-1 genu (případně genu kódujícího specifický sérotyp hlavního histokompatibilního systému HLA-DR4), v USA je komerčně dostupný i test na další genetický marker (IL-6 MyPerioID®, OralDNA® Labs, USA). Stanovované markery mají dle literárních údajů vztah i k periimplantitidě (24) a k řadě dalších systémových onemocnění, jako je diabetes mellitus, revmatická artritida či astma (25, 26, 27).
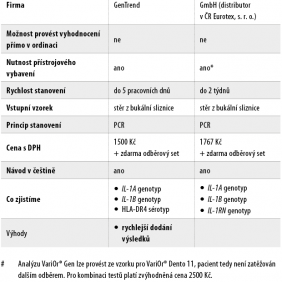
Na českém trhu jsou k dispozici test VariOr® Gen od firmy GenTrend, kterým je možné stanovit dědičný předpoklad k parodontitidě na základě analýzy dvou polymorfizmů v genech pro IL-1alfa (IL-1A) a IL-1beta (IL-1B) a variability v HLA-DR4 genu, a test pro analýzu 3 polymorfizmů v IL-1 genu GenoType® IL-1 (HAIN LIFESCIENCE GmbH) dostupný přes firmu Eurotex, s. r. o., viz tab. III. Oba testy jsou primárně připraveny jako doplněk testů VariOr® Dento 11 nebo micro-IDent®, ovšem test pro zjištění vrozené náchylnosti k zánětlivým onemocněním je možné provést i samostatně.
Postup je velmi jednoduchý, lékař si objedná odběrovou sadu, dle instrukcí provede odběr vzorku buněk z bukální sliznice (lze použít i papírový čep se sulkulární tekutinou, která byla odebrána pro stanovení parodontálních bakterií) a odešle s žádankou vzorek do laboratoře k analýze. Principiálně je test opět založen na PCR a výsledky je možné získat do 5 až 14 dní od zaslání do laboratoře. Vzhledem k tomu, že většina parodontitid nepatří k tzv. monogenním chorobám, nelze toto testování zatím jednoznačně doporučit k hodnocení zvýšeného rizika k rozvoji onemocnění v klinické praxi.
Zatím není nabízen žádný test pro stanovení individuálního rizika vzniku a rozvoje zubního kazu, jsou však snahy o identifikaci genových variant definujících fenotyp mnohočetného kazu v dočasné i stálé dentici (28).
Další komerční testy
Jako nástroj při prevenci onemocnění tvrdých i měkkých zubních tkání nebo při detekci zubního kazu je možné využívat také komerčně dostupné roztoky, výplachy, gely nebo tablety k vizualizaci zubního plaku nebo pro označení kariézních defektů, kazů v dentinu, případně i vstupů do kořenových kanálků. Tyto produkty však obsahují barviva (např. erythrosin, briliantová modř, patentní modř V, fluorescenční barviva), která mohou, dle některých literárních údajů, představovat zdravotní riziko (29, 30), zvláště pokud by byly aplikovány u dětí. Specifikace těchto produktů jsme do naší přehledové práce nezačlenili.
Závěr
S vyšší životní úrovní západní civilizace roste poptávka pacientů po nadstandardní zdravotní péči, ať už se jedná o přímé výkony, nebo i o laboratorní testování. Na českém trhu (eventuálně v EU) jsou nabízeny testy, kterými je možné zjišťovat predispozice pacienta ke vzniku zubního kazu a onemocnění parodontu na základě analýzy jejich sliny, bakterií v dutině ústní a IL-1 genového polymorfizmu. Komerčně dostupné testy mohou být jednotlivé i kombinované. Při analýze sliny jsou testy navrženy tak, aby bylo možné stanovení obsahu vody a hydratace sliny i jejího průtoku, a/nebo pufrovací kapacity sliny a pH. Orální mikroflóra je testována v zubním plaku, ve slinách i v sulkulární tekutině. Sleduje se její složení, měří se počet specifických bakterií (případně i jejich aktivita), jejich procentuální zastoupení, i rezistence k některým typům antibiotik.
Názorná prezentace výsledků analýz vlastností sliny a do jisté míry snad i orální mikroflóry může být vhodným intervenčním nástrojem praktického zubního lékaře k motivaci pacienta k péči o jeho orální zdraví. Vzhledem ke komplexnímu charakteru vybraných orálních onemocnění je vždy nutné výsledky získané laboratorními testy posuzovat společně s detailním klinickým nálezem.
Poznámka: Na českém trhu bylo v minulých letech možné zakoupit testy od firmy Orion Diagnostika (Dentobuff® strip, Dentocult® SM Strip mutans, Dentocult® LB, Dentocult® CA), dle vyjádření zástupce firmy pro ČR se zmíněné testy již od roku 2017 nevyrábějí. Obdobně již není možné zakoupit test Cario-Gene® od firmy Protean. Všechny ceny testů jsou uvedeny s DPH k datu 14. 2. 2018 a bez poštovného.
Poděkování
Článek vznikl s podporou Ministerstva zdravotnictví České republiky, grant č. NV 17-30439A, grantu GAČR GB14-37368G, projektu Specifický výzkum MUNI/A/1008/2017 a z prostředků poskytnutých Lékařskou fakultou MU juniorskému výzkumníkovi Petře Bořilové Linhartové.
Konflikt zájmů
Autoři nemají žádný konflikt zájmů, vazbu na osoby zabývající se výrobou či distribucí uvedených produktů máme jen v rovině výzkumné, případně jako běžní zákazníci.
Obrazová dokumentace
Literatura
1. Jepsen S, Blanco J, Buchalla W, et al. Prevention and control of dental caries and periodontal diseases at individual and population level: consensus report of group 3 of joint EFP/ORCA workshop on the boundaries between caries and periodontal diseases. J Clin Periodontol, 2017, 44 (Suppl 18): S85–S93. doi: 10.1111/jcpe.12687.
2. Bořilová Linhartová P, Izakovičová Hollá L. Léčiva a lékové formy jako rizikové faktory pro zubní kaz. Česká a slovenská farmacie, 2017, 66(3): 103–106.
3. Bradshaw DJ, Lynch RJ. Diet and the microbial aetiology of dental caries: new paradigms. Int Dent J, 2013 63 (Suppl 2): 64–72. doi: 10.1111/idj.12082.
4. Aas JA, Griffen AL, Dardis SR, et al. Bacteria of dental caries in primary and permanent teeth in children and young adults. J Clin Microbiol, 2008, 46(4): 1407–17. doi: 10.1128/JCM.01410-07.
5. Socransky SS, Haffajee AD, Cugini MA, Smith C, Kent RL Jr. Microbial complexes in subgingival plaque. J Clin Periodontol, 1998, 25(2): 134–144. doi:10.1111/j.1600 – 051X.1998.tb02419.x.
6. Tettamanti L, Gaudio RM, Cura F, Mucchi D, Illuzzi N, Tagliabue A. Prevalence of periodontal pathogens among italian patients with chronic periodontitis: a retrospective study on 2992 patients. Oral Implantol (Rome), 2017, 10(1): 28–36. doi: 10.11138/orl/2017.10.1.028.
7. Van der Velden U. What exactly distinguishes aggressive from chronic periodontitis: is it mainly a difference in the degree of bacterial invasiveness? Periodontol 2000, 2017, 75(1): 24–44. doi: 10.1111/prd.12202.
8. Könönen E, Müller HP. Microbiology of aggressive periodontitis. Periodontol 2000, 2014, 65(1): 46–78. doi: 10.1111/prd.12016.
9. Nibali L. Aggressive Periodontitis: microbes and host response, who to blame? Virulence, 2015, 6(3): 223–228. doi: 10.4161/21505594.2014.986407.
10. Mombelli A. Microbial colonization of the periodontal pocket and its significance for periodontal therapy. Periodontol 2000, 2018, 76(1): 85–96. doi: 10.1111/prd.12147.
11. Lai PC, Schibler MR, Walters JD. Azithromycin enhances phagocytic killing of Aggregatibacter actinomycetemcomitans Y4 by human neutrophils. J Periodontol, 2015, 86(1): 155–161. doi: 10.1902/jop.2014.140183.
12. Huth KC, Quirling M, Lenzke S, Paschos E, et al. Effectiveness of ozone against periodontal pathogenic microorganisms. Eur J Oral Sci, 2011, 119(3): 204–210. doi: 10.1111/j.1600-0722.2011.00825.x.
13. Fernandes T, Bhavsar C, Sawarkar S, D‘souza A. Current and novel approaches for control of dental biofilm. Int J Pharm, 2018, 536(1): 199–210. doi: 10.1016/j.ijpharm.2017.11.019.
14. da Silva MK, de Carvalho ACG, Alves EHP, da Silva FRP, Pessoa LDS, Vasconcelos DFP. Genetic Factors and the Risk of Periodontitis Development: Findings from a Systematic Review Composed of 13 Studies of Meta-Analysis with 71,531 Participants. Int J Dent, 2017, 2017: 1914073. doi: 10.1155/2017/1914073.
15. Bořilová Linhartová P, Valová S, Kaštovský J, et al. Genová variabilita v imunoregulačních faktorech u pacientů s chronickou parodontitidou a diabetes mellitus. Čes. stomatol. Prakt. zubní lék., 2015, 115 (4), 89–97.
16. Ramsay DS, Rothen M, Scott JM, Cunha-Cruz J. Tooth wear and the role of salivary measures in general practice patients. Clin Oral Investig, 2015, 19(1): 85–95. doi: 10.1007/s00784-014-1223-4.
17. Maldupa I, Brinkmane A, Mihailova A. Comparative analysis of CRT Buffer, GC saliva check buffer tests and laboratory titration to evaluate saliva buffering capacity. Stomatologija, 2011, 13(2): 55–61.
18. Cheaib Z, Ganss C, Lamanda A, Turgut MD, Lussi A. Comparison of three strip-type tests and two laboratory methods for salivary buffering analysis. Odontology, 2012, 100(1): 67–75. doi: 10.1007/s10266-011-0018-1.
19. Maheaswari R, Kshirsagar JT, Lavanya N. Polymerase chain reaction: A molecular diagnostic tool in periodontology. J Indian Soc Periodontol, 2016, 20(2): 128–135. doi: 10.4103/0972-124X.176391.
20. Poskerová H, Bořilová Linhartová P, Cvanová M, Izakovičová Hollá L. Vliv onemocnění diabetes mellitus na stav chrupu a parodontu. Čes. stomatol. Prakt. zubní lék., 2018, 118(1): 3–12.
21. Borilova Linhartova P, Vokurka J, Poskerova H, Fassmann A, Izakovicova Holla L. Haplotype analysis of interleukin-8 gene polymorphisms in chronic and aggressive periodontitis. Mediators Inflamm, 2013, 2013: 342351.
22. Borilova Linhartova P, Kastovsky J, Lucanova S, et al. Interleukin-17A gene variability in patients with type 1 diabetes mellitus and chronic periodontitis: its correlation with IL-17 levels and the occurrence of periodontopathic bacteria. Mediators Inflamm, 2016, 2016: 2979846.
23. Hughes D, Andersson DI. Environmental and genetic modulation of the phenotypic expression of antibiotic resistance. FEMS Microbiol Rev, 2017, 41(3): 374–391. doi: 10.1093/femsre/fux004.
24. Liao J, Li C, Wang Y, et al. Meta-analysis of the association between common interleukin-1 polymorphisms and dental implant failure. Mol Biol Rep, 2014, 41(5): 2789–2798. doi: 10.1007/s11033-014-3133-6.
25. Luotola K, Pietilä A, Zeller T, et al. Associations between interleukin-1 (IL-1) gene variations or IL-1 receptor antagonist levels and the development of type 2 diabetes. J Intern Med, 2011, 269(3): 322–332. doi: 10.1111/j.1365-2796.2010.02294.x.
26. Lee YH, Bae SC. Associations between interleukin-1 and IL-1 receptor antagonist polymorphisms and susceptibility to rheumatoid arthritis: A meta-analysis. Cell Mol Biol (Noisy-le-grand), 2015, 61(8): 105–111.
27. He Y, Peng S, Xiong W, Xu Y, Liu J. Association between polymorphism of interleukin-1 beta and interleukin-1 receptor antagonist gene and asthma risk: a meta-analysis. Scientific World Journal, 2015, 2015: 685684. doi: 10.1155/2015/685684.
28. Kornman KS, Polverini PJ. Clinical application of genetics to guide prevention and treatment of oral diseases. Clin Genet, 2014, 86(1): 44–49. doi: 10.1111/cge.12396.
29. Tanaka T. Reproductive and neurobehavioural toxicity study of erythrosine administered to mice in the diet. Food Chem Toxicol, 2001, 39(5): 447–454. doi: 10.1016/S0278-6915(00)00163-0.
30. Yuan CJ, Marikawa Y. Developmental toxicity assessment of common excipients using a stem cell-based in vitro morphogenesis model. Food Chem Toxicol, 2017, 109(Pt 1): 376–385. doi: 10.1016/j.fct.2017.09.023.
17. 2. 2019
Print: LKS. 2019; 29(2): 30 – 37
Autoři:
- Petra Bořilová Linhartová
- Denisa Kavříková
- Simona Slezáková
- Martina Kukletová
- Lydie Izakovičová Hollá
Fotografie
- Petra Bořilová Linhartová
Rubrika:
Téma: