Kalciumsilikátové cementy – 2. část: Klinické využití
Přehledové sdělení
Souhrn: Kalciumsilikátové cementy tvoří nezbytnou součást vybavení každého praktického zubního lékaře, který se hlouběji zajímá o endodoncii a konzervační zubní lékařství. Původně byly uvedeny na trh jako materiály vhodné ke zhotovení retrográdní výplně při chirurgické endodoncii a k opravě perforací kořene. Od pčátku využívání kalciumsilikátových cementů se jejich indikační spektrum nevídaně rozšířilo, a to včetně výkonů se zachováním vitality nebo zaplnění celého kořenové kanálku. Cílem druhé části tohoto sdělení je shrnout klinické indikace využití kalciumsilikátových cementů, výhody a nevýhody při ošetřeních jednotlivými materiály rozličných generací kalciumsilikátových cementů a některé klíčové kroky daných ošetření, které jsou zásadní pro dosažení vysoké úspěšnosti výkonů.
Klíčová slova: MTA, Biodentin, Totalfill, kalciumsilikátové cementy
Calcium silicate cements Part 2: clinical indications
Review article
Summary: Calcium silicate cements represent an integral piece of equipment of every general dentist who is deeply interested in endodontics and restorative dentistry. Originally, they were introduced to market as a material suitable for retrograde fillings in endodontic surgery and for the treatment of root perforations. Since then the spectrum of indications of calcium silicate cements has widened unprecedentedly. The aim of the second part of the review is to summarize the clinical indications for the use of calcium silicate cements, advantages and disadvantages of different generations of calcium silicate cements and some of the key steps of treatment which are fundamental to achieving their high success rate.
Key words: MTA, Biodentin, Totalfill, calcium silicate cements
Úvod
Původně byly kalciumsilikátové cementy uvedeny na trh v roce 1997 jako vhodné materiály pro ošetření perforací kořene a retrográdní výplň při resekci kořenového hrotu. Velmi rychle se ale objevily další možné indikace těchto materiálů, a to jak v endodoncii (pulpotomie, maturogeneze, zaplnění kořenových kanálků, ošetření stálých zubů s neukončeným vývojem), tak i mimo endodoncii (přímé překrytí zubní dřeně) – to vše díky vysoké míře biokompatibility, antimikrobiálnímu působení a velmi dobrému utěsnění (viz 1. část sdělení, LKS 2/2018).
Retrográdní výplň
Jedno z prvních využití našly kalciumsilikátové cementy v retrográdní endodontické chirurgii. Význam aplikace retrográdní výplně v rámci endodontické chirurgie je často zdůrazňován (1), neboť za hlavní příčinu chronické apikální periodontitidy po provedeném ortográdním endodontickém ošetření se považuje apikální netěsnost kořenové výplně, kterou unikají bakterie a jejich produkty z infikovaného systému kořenových kanálků do periapikálního prostoru (2). Retrográdní výplň by měla dokonale hermeticky těsnit tak, aby zbývající bakterie a jejich produkty nemohly systém kořenových kanálků opustit nebo do něj naopak vniknout (1).
To klade vysoké nároky na využitý materiál. Měl by být rentgenkontrastní, objemově stálý, baktericidní či bakteriostatický, neresorbovatelný, neměl by být ovlivněn přítomnou vlhkostí a měla by s ním být snadná manipulace. Měl by se také dobře adaptovat ke stěnám kořenového kanálku (3). Dále by měl dokonale utěsnit systém kořenových kanálků, být tolerován periapikálními tkáněmi a neměl by být toxický (2).
Kalciumsilikátové cementy splňují naprostou většinu těchto požadavků. Oproti většině ostatních materiálů tuhnou kalciumsilikátové cementy ve vlhkém prostředí. To je velkou výhodou, neboť v průběhu periapikální chirurgie je téměř nemožné dosáhnout absolutně suchého pole (2). Jedinými nevýhodami první generace kalciumsilikátových cementů je obtížná manipulace – zvlášť materiál MTA je tímto proslulý – a poměrně dlouhá doba tuhnutí, která se pohybuje kolem 3–4 hodin (4), což může vést k vyplavení části materiálu (5). Tyto nevýhodné vlastnosti byly potlačeny u třetí generace kalciumsilikátových cementů. Materiály konzistence putty mají velmi dobré manipulační vlastnosti, které jsou srovnatelné s Immediate Restorative Material (IRM) nebo Super EBA (angl. ethoxy benzoic acid), jež se považují za materiály s optimálními manipulačními vlastnostmi. V třetí generaci kalciumsilikátových cementů existuje i varianta konzistence putty tzv. rychle tuhnoucí (angl. fast set), jejíž doba tuhnutí je srovnatelná s materiálem Biodentin (tj. cca 15 minut).
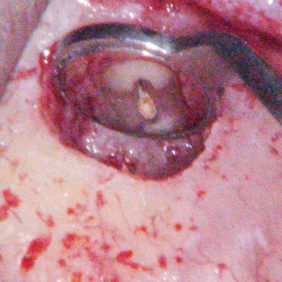
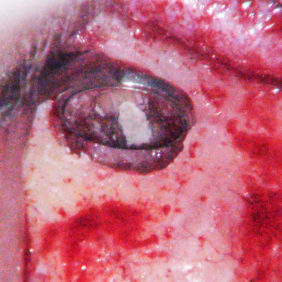
Preparace retrográdní kavity pro kalciumsilikátové cementy je totožná s ostatními materiály. Je vhodné, aby resekce kořenového hrotu byla provedena kolmo na podélnou osu kořene a následná retrográdní kavita byla aspoň 3 mm hluboká. Některé práce naznačují, že delší retrográdní výplň těsní lépe (6). Nicméně v porovnání s jinými materiály bylo při tloušťce materiálu 3 mm prokázáno, že lépe těsní kalciumsilikátové cementy (7–9).
Kromě materiálu samotného je důležitý i tvar a konfigurace retrográdní kavity. Měla by být rovnoběžná s podélnou osou kořene a mít rovné, hladké stěny, aby bylo možné materiál dobře kondenzovat. K tomuto účelu jsou ideální ultrazvukové koncovky (obr. 1a), (obr. 1b), (obr. 1c), (obr. 1d), které mají upravený tvar pro retrográdní kavitu v různých lokalizacích. Není rozdíl v kvalitě povrchů retrográdních kavit při využití ultrazvukových koncovek a diamantových brousků (10), avšak dosáhnout optimálního přístupu k vytvoření retrográdní kavity pomocí diamantových brousků je téměř nemožné. Je nutné zdůraznit, že by se ultrazvukové retrográdní koncovky měly používat při menších intenzitách a celkový čas by měl být co nejkratší, jinak hrozí zvýšené riziko vzniku mikroprasklin, které mohou vést k selhání terapie (11). Někteří autoři doporučují po zhotovení retrográdní výplně provést ohlazení povrchu, které by mělo zmenšit výskyt spár mezi stěnou kavity a materiálem. Nicméně toto závěrečné leštění nemá vliv na okrajovou adaptaci materiálu MTA (12).
Perforace kořene
O klinické úspěšnosti ošetření perforací a jejich prognóze nebylo publikováno mnoho, ale předpokládá se, že dlouhodobé přežití zubu závisí na více lokálních faktorech, jako je umístění, velikost, přítomnost nebo absence kontaminace a čas (13, 14). Mezi nejdůležitější faktory patří dezinfekce okolí perforace a její hermetické utěsnění (15). Nicméně je nutné konstatovat, že i přes chybějící důkazy v podobě dlouhodobých klinických studií se s rozšířením využití materiálu MTA a kalciumsilikátových cementů změnilo očekávání úspěšnosti ošetření perforací (16). Ošetření se také stalo rychlejším, efektivnějším a mnohem předpověditelnějším (13, 17–19).
Faktory ovlivňující úspěšnost ošetření perforací
1. Čas
Všeobecně se uznává fakt, že čím dříve se po jejím vytvoření perforace ošetří, tím je lepší její prognóza (13). Nekontaminované perforace se na zvířecích modelech hojily signifikantně rychleji a lépe než perforace kontaminované (20). Pokud vznikne komunikace mezi perforací a dutinou ústní, dochází ke zhoršenému hojení v důsledku rozšíření bakteriální infekce z dutiny ústní do dentinu ohraničujícího perforaci. To zhoršuje prognózu ošetření perforace (21).
2. Velikost perforace
Čím je přítomna větší perforace, tím náročnější a komplexnější je její ošetření. Velmi často je obtížná kontrola krvácení a téměř vždy je nutné využít techniku vnitřní matrice, kdy se prostor pod perforací vyplní resorbovatelným materiálem (22). U rozsáhlých perforací je však nutné počítat se zhoršenou prognózou, jelikož zde je zvýšené riziko nedokonalého utěsnění perforace, a takový zub je mechanicky oslabený.
3. Lokalizace perforace
Perforace mohou vzniknout v různých fázích endodontického ošetření, a to od vytváření trepanačního otvoru až po preparaci na kořenovou nástavbu nebo kořenový čep. Anatomie zubu a lokalizace perforace velmi ovlivňuje náročnost ošetření defektu a tím samozřejmě i jeho prognózu.
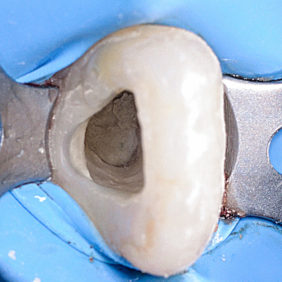
a) Perforace dna dřeňové dutiny
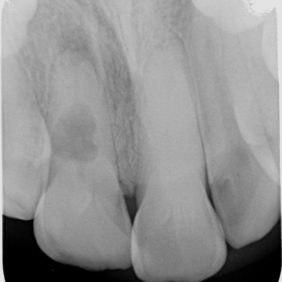
Tato komplikace endodontického ošetření nastává při hledání vstupů do kořenových kanálků bez vizuální kontroly (obr. 2a), (obr. 2b), (obr. 2c). Zde je nutné rozlišit, zda je perforace nad úrovní okraje alveolární kosti (supraalveolární, tj. „suprakrestálně“) a zasahuje oblast gingivodentálního uzávěru zubu, nebo je pod úrovní okraje alveolární kosti (intraalveolární, tj. „subkrestálně“). V případě nejasnosti je možné využít k ověření přítomnosti perforace apexlokátor nebo zhotovit situační snímek se zavedeným kořenovým nástrojem. Pokud je přítomna supraalveolární perforace, není vhodné využít k uzavření perforace kalciumsilikátové cementy. Je to dáno poměrně dlouhou dobou, kterou potřebují ke ztuhnutí, a vyšší tendencí k odplavení. V těchto případech je metodou volby chirurgické prodloužení klinické korunky nebo rekonstrukce pomocí kompozitního materiálu, skloionomerního cementu nebo amalgámu. Pokud se jedná o intraalveolární perforaci, je vhodné ji ošetřit poté, co jsou nalezeny vstupy kořenových kanálků a je proveden koronální flaring (21).
b) Perforace stěny kořenového kanálku
- Koronální třetina: tyto perforace nejčastěji vznikají při razantním rozšíření vstupu do kořenového kanálku, zpravidla nástroji typu Gates-Glidden. Nejčastěji bývají postiženy tzv. nebezpečné zóny (angl. danger zones) – furkační stěny u meziálních kořenů dolních molárů a meziobukálních kořenů horních molárů. Podle některých autorů mají tyto perforace nejhorší dlouhodobou prognózu (22), která je dána velkou pravděpodobností vzniku komunikace s dutinou ústní a rychlou bakteriální kontaminací perforace. Ošetření koronálních perforací by mělo být nechirurgické, jelikož chirurgické ošetření koronálních perforací končí vznikem parodontálního chobotu. Výjimkou jsou situace, kdy je koronálněji od perforace zachován lem kosti nebo je provedeno chirurgické prodloužení klinické korunky a perforace je následně umístěna supragingiválně (21). To ale může zvláště ve frontálním úseku působit značně neesteticky.
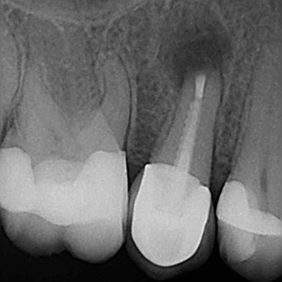
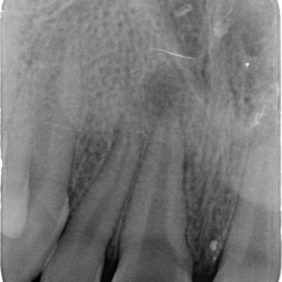
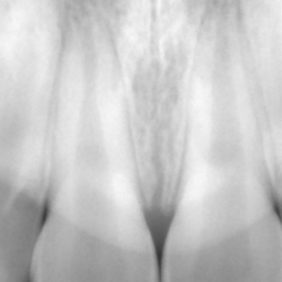
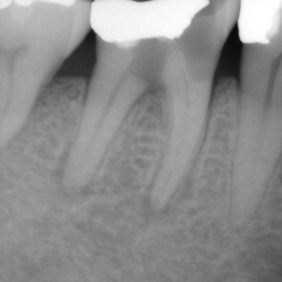
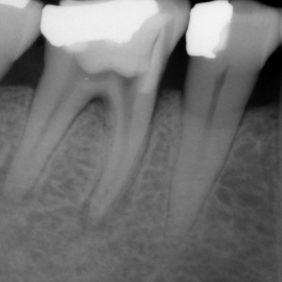
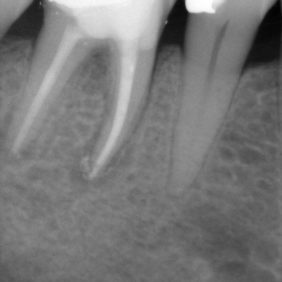
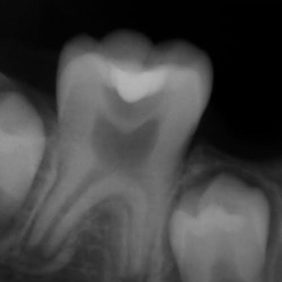
- Střední třetina: vznik těchto perforací je shodný se vznikem perforací v apikální třetině. Nejčastěji není respektován průběh kořenového kanálku a dochází ke vzniku zářezu (angl. ledging) a následně k perforaci. Poměrně často také dochází k těmto perforacím při preparaci na kořenové nástavby. Prognóza těchto perforací je závislá zvláště na možnostech opracování a dekontaminace původního kořenového kanálku. Následně je vhodné apikální pokračování kořenového kanálku zaplnit gutaperčou a sealerem a od místa perforace koronálně kalciumsilikátovým cementem. Druhou možností je zaplnit celý kořenový kanálek kalciumsilikátovým cementem (obr. 3a), (obr. 3b). Obecně mají perforace umístěné ve střední třetině kořene lepší prognózu než perforace koronální (21).
- Apikální třetina: zde kromě vzniku zářezu a transportace kořenového kanálku hraje roli ještě možnost perforace apexu neboli jeho nadměrné rozšíření (apikální zipping). Tyto perforace jsou většinou velmi dobře řešitelné jak ortográdně, tak retrográdně.
Zaplnění kořenového kanálku
Využití kalciumsilikátových sealerů
Zde se doporučuje využít techniky centrálního čepu. Při využití vertikální kondenzace za tepla se snižuje vazba sealeru na dentin (23). Hlavní výplňovou hmotou se tak stává samotný sealer a gutaperča spíše pomocnou hmotou, která zmenšuje množství využitého kalciumsilikátového sealeru a umožňuje případné reendodontické ošetření, jelikož samotný kalciumsilikátový cement je velmi obtížné odstranit (24). Nicméně pokud jsou využity spolu s technikou vertikální kondenzace za tepla nebo technikou centrálního čepu, jenž není záměrně zkrácen, tak při reendodontickém ošetření není oproti jiným sealerům rozdíl (25, 26).
Lawaty technika
Jde o techniku podle dr. Ingrid Lawaty. Pro plnění touto technikou se doporučuje spíše konzervativní preparace, ideálně stálý kónus 4° pro vytvoření dostatečného prostoru, který umožní kondenzaci materiálu. Ke vstupům do kořenových kanálků je naneseno MTA v konzistenci vlhkého písku a po celou dobu plnění se udržuje ve stejné konzistenci přidáváním fyziologického roztoku (nebo dodaného roztoku k namíchání materiálu). Takto aplikovaný materiál slouží jako rezervoár. Následně je použita sekvence ručních nástrojů typu K-file, kterými se materiál dopravuje apikálně. První z nich by měl mít menší rozměr než hlavní apikální nástroj (angl. master apical file, MAF). S nástroji typu K-file se jemně pohybuje nahoru a dolů a rotuje se proti směru hodinových ručiček ve snaze apikálně kondenzovat materiál. Doporučuje se vytvořit apikální zátku s apexlokátorem, jenž při dodržení délky nástroje bude ukazovat větší vzdálenost oproti pracovní délce dříve změřené a kvůli zvýšenému odporu MTA. Postupně se využívají nástroje typu K-file větších průměrů, dokud nedosáhneme místa koronálního ukončení kořenové výplně (27).
Augerova technika
Výhody této techniky jsou velmi podobné jako u Lawaty techniky. Tato technika se dá využít i při konzervativní preparaci a náročnější anatomické konfiguraci kořenového systému. Principiálně se jedná o použití konvenčních nikltitanových nástrojů o stálém kónusu 4° nebo 6°. Těmito nástroji se rotuje taktéž proti směru hodinových ručiček a kombinuje se s tzv. „pecking motion“ (koronoapikální kondenzace). Nástroje s menší kónicitou využíváme zvláště v apikální části, pokud je přítomno výrazné apikální zahnutí (tzv. apikální háček). V tomto případě je výhodnější apikální zátku vytvořit pomocí Lawaty techniky. Ve střední a koronální třetině je výhodnější používat nástroje s větší kónicitou (28).
Kondenzace pomocí modifikovaných thermafilových
nosičů
U širších kořenových kanálků s výraznějším apikálním zahnutím je velmi obtížné využít Augerovu nebo Lawaty techniku. Taktéž někdy není možné využít rigidní pluggery a v takovéto indikaci je velmi výhodné využít modifikované thermafilové čepy. Thermafilové čepy mají poměrně flexibilní, ale zároveň pevné plastové nosiče. Po odstranění gutaperči z povrchu nosiče a zarovnání čela lze získat celou sadu poměrně výrazně flexibilních pluggerů (29).
Konvenční kondenzace
U rovnějších a širších kořenových kanálků je možné kondenzovat kalciumsilikátový cement pomocí konvenčních pluggerů, papírových čepů nebo s pomocí ultrazvukových přístrojů. Využití ultrazvuku při kondenzaci kalciumsilikátových cementů je kontroverzní a dosud dostupná literatura je protichůdná. Některé práce naznačují, že kondenzací bez využití ultrazvuku se dosáhne lepší adaptace ke stěnám kořenových kanálků a dochází k menší tvorbě nehomogenit (30, 31). Naopak jiné práce dospěly k závěru, že kalciumsilikátové cementy kondenzované za pomoci ultrazvuku jsou více denzní (32), mají vyšší pevnost v tlaku (33) a lepší adaptaci ke stěnám kořenových kanálků (34) a lépe těsní (35). Ostatní práce se přiklánějí k názoru, že mezi jednotlivými technikami není rozdíl (36, 37), ale při prodloužené adaptaci materiálu ultrazvukem dochází ke zmenšení tvrdosti a jeho zhoršené schopnosti těsnit. Vysvětluje se to nadměrným odstraněním vlhkosti při adaptaci materiálu a následnou absencí hydratační reakce ve všech částech materiálu (38).
Apikální zátka z kalciumsilikátového cementu
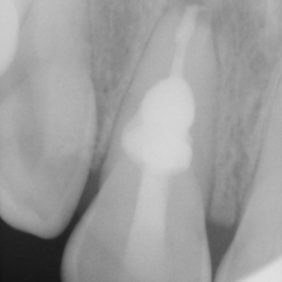
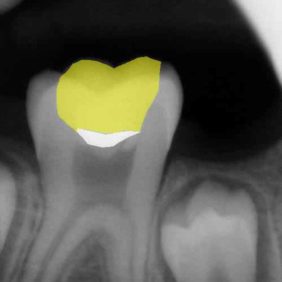
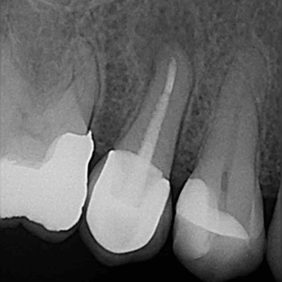
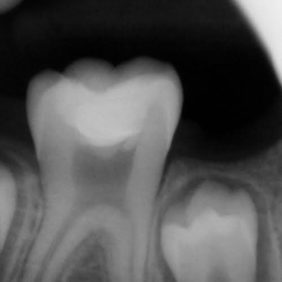
Ošetřování stálých zubů s neukončeným vývojem klade na ošetřujícího lékaře větší nároky zvláště kvůli široce otevřenému foramen apicale. K zamezení extruze materiálu skrze foramen apicale lze někdy využít techniku vnitřní matrice (angl. inner matrix technique), kdy se skrze foramen apicale protlačí do periapikální oblasti resorbovatelný materiál, vůči kterému se kondenzuje kalciumsilikátový cement (22, 39). Mezi materiály využívané pro zhotovení vnitřní matrice patří atelokolagen, oxidovaná celulóza, dihydrát síranu vápenatého nebo kostní augmentační materiál. Nejmenší použitý plugger by mělo být možno volně zavést zhruba 0,5 mm od konce pracovní délky. Kalciumsilikátový cement se aplikuje do střední nebo apikální třetiny a následně je vzestupnou řadou pluggerů dokončena kondenzace. V průběhu kondenzace je možné odsát nadbytečnou vlhkost pomocí papírových čepů. Všeobecně se doporučuje rentgenologická kontrola po vytvoření apikální zátky. Jakmile je vytvořena apikální zátka, je téměř nemožné materiál dokondenzovat více apikálně (15). Apikální zátka by měla být minimálně 3–5 mm silná, aby dokonale těsnila (35, 40–42). Dříve se nedoporučovala aplikace tlustší vrstvy materiálu ProRoot MTA kvůli možnosti vzniku infrakcí ve stěně kořenového kanálku (43) (obr. 4a), (obr. 4b). Faktem je, že původní materiál ProRoot MTA expandoval mnohonásobně více než materiál ProRoot MTA white, který expanduje téměř zanedbatelně (44, 45). Při využití tohoto materiálu není chybou aplikovat i vrstvu tlustší než 5 mm (obr. 5a), (obr. 5b).
Přímé překrytí
Přímé překrytí zubní dřeně a celkově výkony se zachováním vitality zubní dřeně vzbuzují velké kontroverze. Před uvedením kalciumsilikátových cementů na trh dokonce Americká asociace endodontistů nedoporučovala přímé překrytí zubní dřeně vůbec (46). Jako hlavní příčina nepříznivých výsledků se udává bakteriální infekce – a to ať už ponechaná v podobě infikované zubní dřeně, nebo v podobě sekundární infekce, podmíněné nevyhovujícím okrajovým uzávěrem výplně (47). V současné době se pro úspěšné přímé překrytí udávají dvě základní podmínky, a to: 1. zdravá, neinfikovaná dřeň, na kterou se aplikuje materiál, a 2. hermetický uzávěr perforace.
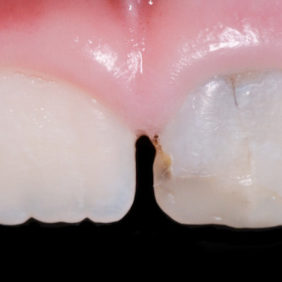
Už první histologické studie porovnávající úspěšnost přímého překrytí materiálem MTA v porovnání s hydroxidem vápenatým vykazovaly lepší výsledky u kalciumsilikátového cementu (48) (obr. 6a), (obr. 6b), (obr. 6c). Některé klinické práce tento potenciál potvrzují (49). Existují ale i klinické práce, které vykazují stejnou úspěšnost ošetření jak při využití kalciumsilikátového cementu, tak při využití hydroxidu vápenatého (50, 51). Je nutné ale vyzdvihnout, že oproti předchozím pracím nebyl stanoven přesný klinický protokol a jedna z těchto prací sleduje úspěšnost pregraduálních studentů (51). Z toho se dá vyvodit, že úspěšnost ošetření bude velmi závislá na pečlivosti ošetřujícího lékaře a splnění výše zmíněných podmínek.
V současné době činí největší obtíže určení „zdravé dřeně“. Bylo zjištěno, že subjektivní obtíže pacienta nemusí plně odpovídat histologickým změnám dřeně (52), a tak jedinou možností, jak rozlišit reverzibilní a ireverzibilní zánět zubní dřeně, je možnost dosažení hemostázy v místě perforace. Pokud není možné aplikací koncentrovaného chlornanu sodného po dobu 5 až 10 minut zastavit krvácení, jedná se s velkou pravděpodobností o ireverzibilní postižení zubní dřeně (49, 53). Koncentrovaný chlornan sodný (2,5–6%) se doporučuje pro jeho antimikrobiální a hemostatické působení. Dále také pro jeho proteolytické vlastnosti, kdy odstraňuje poškozené buňky a nekrotickou tkáň z povrchu perforace (49, 54, 55). Takto krátkodobě působící chlornan sodný ale nemůže být úspěšný při eliminaci bakterií z dentinových tubulů v bezprostředním okolí perforace. Zde se doporučuje aplikovat kalciumsilikátový cement přes okraje perforace nejen kvůli hermetickému okrajovému uzávěru díky vzniku mezivrstvy (56), ale i kvůli antimikrobiálnímu působení samotného kalciumsilikátového cementu (49). Aby překrytí bylo dokonale hermetické, doporučuje se aplikovat vrstvu kalciumsilikátového cementu aspoň 1,5 mm silnou. V okolí překryté perforace by ale měl zůstat minimálně 1 mm široký lem dentinu, aby bylo možné zhotovit definitivní adhezivní rekonstrukci. Nevýhodou tohoto postupu jsou nedokonalé mechanické vlastnosti kalciumsilikátových cementů 1. generace. Pevnost tlaku materiálu ProRoot MTA se udává mezi 45 a 98 MPa (57, 58), zatímco pevnost tlaku v dentinu je kolem 300 MPa (59). Z dlouhodobého hlediska se zdá být materiál MTA za těchto podmínek nevhodný. Mnohem výhodnější se zdá být využití 2. generace kalciumsilikátových cementů v podobě materiálu Biodentin, který nejenže má mnohem kratší dobu tuhnutí, ale i jeho modulus elasticity je srovnatelný s dentinem (60). Navíc je jeho konzistence mnohem příjemnější na manipulaci než materiál MTA.
Pulpotomie
Pulpotomie dočasných zubů
Pulpotomie je definována jako amputace postižené či infikované koronální části pulpy se současným zachováním vitality a funkce zbývající radikulární dřeně. V rámci pulpotomií dočasných zubů je rozšířeno používání zvláště hydroxidu vápenatého, formokresolu a právě kalciumsilikátových cementů. Zejména formokresol si získal velkou oblibu i přes kontroverze ohledně jeho toxicity, karcinogenity, mutagenity a možnosti vzniku alergických reakcí (61), byť jej dnes již řada autorů odmítá.
Kalciumsilikátové cementy nemají žádné takové nežádoucí vlastnosti a při porovnání s ostatními materiály se zdají být lepší (62 – 64) nebo přinejhorším porovnatelné s ostatními používanými materiály (65, 66). Jeden ze zmiňovaných materiálů, hydroxid vápenatý, se v současné době nedoporučuje používat u pulpotomií dočasných zubů pro vysokou incidenci resorpcí a nízkou úspěšnost terapie (67, 68).
Pulpotomie stálých zubů
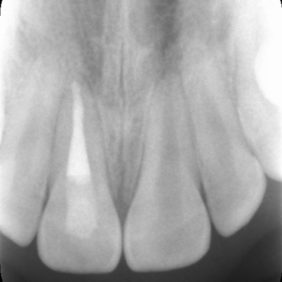
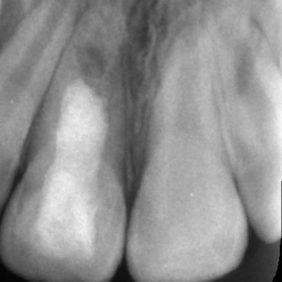
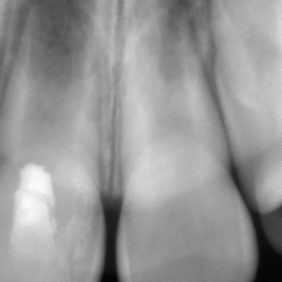
Původně byla parciální nebo totální pulpotomie indikována u traumatické nebo kariézní expozice zubní dřeně stálého zubu s nedokončeným vývojem. Cílem tohoto ošetření bylo zajištění dokončení vývoje kořene (69). V porovnání se zlatým standardem v podobě hydroxidu vápenatého bylo histologicky dosaženo lepších výsledků při využití materiálu MTA (70–72). Zvláště se ukazuje, že dochází k tvorbě širšího a homogennějšího dentinového můstku (70, 72). Doporučuje se aplikovat 1,5–3 mm silnou vrstvu MTA a umístit ji pod úroveň cementosklovinné hranice, a to kvůli riziku vzniku cervikální dyskolorace (obr. 7) (69).
V nedávné době bylo publikováno i několik klinických prací zabývajících se ošetřením ireverzibilní pulpitidy pomocí hluboké pulpotomie u stálých zubů s dokončeným vývojem kořene. Toto ošetření vychází ze starých histologických studií z 60. a 70. let 20. století, kde bylo zjištěno, že zánětlivě změněná dřeň se u ireverzibilní pulpitidy v naprosté většině nachází v koronální části dřeně (73–75). Histologicky byla potvrzena úspěšnost této terapie na lidech (76) a dosud publikované prospektivní studie ukazují vysokou míru úspěšnosti (77, 78), která je srovnatelná s konvenčním endodontickým ošetřením, a to i co se postoperační citlivosti týče (78). Nicméně u tohoto ošetření nehrozí komplikace spojené s opracováním, dezinfekcí a zaplněním kořenového systému, a proto se zdá být vhodnou alternativou při ošetření pulpitických zubů s velmi komplikovanou anatomickou konfigurací. Nevýhodou tohoto ošetření je ztráta možné kontroly vitality u následných kontrol.
Regenerativní endodoncie
V roce 2004 byla vydána první publikace regenerativního endodontického postupu, u kterého byl využit materiál ProRoot MTA jako koronální zátka (79). Při tomto ošetření se stimuluje krvácení z periapikální oblasti a po následné stabilizaci koagula se na něj aplikuje koronální zátka (obr. 8a), (obr. 8b), (obr. 8c). Od té doby se materiál MTA stal zlatým standardem u regenerativních endodontických postupů (též známé jako revaskularizace, revitalizace, či maturogeneze) (39).
Teprve až zvýšená četnost cervikálních dyskolorací vedla ke změně doporučení Americké asociace endodontistů, která ve frontálním úseku postavila na stejnou úroveň materiál Biodentin, u něhož je míra dyskolorací v porovnání s materiálem ProRoot MTA menší (80–82). Nicméně i tento materiál má v přítomnosti krve stejný potenciál k dyskoloracím jako materiál ProRoot MTA (81, 83). I když jednotlivá in vitro studie naznačuje opak (84), převažují důkazy, že kalciumsilikátové cementy 2. a 3. generace mají potenciál k vzniku cervikálních dyskolorací menší. Klinicky se aplikuje zhruba 2–3 mm materiálu na koagulum stabilizované v úrovni cementosklovinné hranice nebo lehce pod ní. Zde je nutné kondenzovat materiál velmi jemně a opatrně, neboť hrozí zvýšené riziko apikální dyslokace.
Závěr
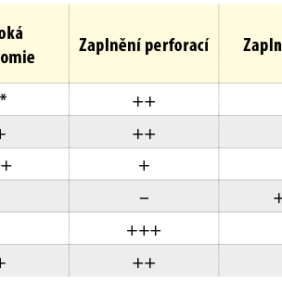
Kalciumsilikátové cementy jsou skupinou materiálů, bez které se v současné době v moderní endodoncii, endodontické chirurgii a konzervačním zubním lékařství neobejdeme. Základní znalosti chemického složení a fyzikálních vlastností jednotlivých generací nám umožní vybrat ten nejvhodnější materiál pro danou klinickou situaci (tab. I).
Velkými výhodami těchto materiálů je jejich schopnost tuhnout za přítomnosti vlhka, následná vysoká míra biokompatibility a velmi dobré okrajové utěsnění. Největší nevýhoda klinického využití původních materiálů je velmi obtížná manipulace, která vyžaduje zručnost a i velkou míru trpělivosti. U novějších generací je tato nevýhoda již oslabena, zvláště s materiály 3. generace se manipuluje jednoduše. Tento fakt je ale kompenzován velmi vysokou cenou, která omezuje širší využití u praktických zubních lékařů.
Publikace vznikla za podpory grantu
IGA_LF_2016_007 a projektu HŽ_2017_2705.
Obrazová dokumentace
Literatura
1. Kim S, Kratchman S. Modern endodontic surgery concepts and practice: a review. J Endod, 2006, 32(7): 601–623.
2. Baek SH, Shin SJ. Root-End Fillings Using MTA. In: M. Torabinejad, editor. Mineral trioxide aggregate: properites and clinical applications. John Wiley & Sons, 2014, 1. vydání, 251–280.
3. Gartner AH, Dorn SO. Advances in endodontic surgery. Dent Clin North Am, 1992, 36(2): 357–378.
4. Torabinejad M, Hong CU, McDonald F, Pitt Ford TR. Physical and chemical properties of a new root-end filling material. J Endod, 1995, 21(7): 349–353.
5. Formosa LM, Damidot D, Camilleri J. Mercury intrusion porosimetry and assessment of cement-dentin interface of anti- washout-type mineral trioxide aggregate.
J Endod, 2014, 40(7): 958–963.
6. Valois CR, Costa ED Jr. Influence of the thickness of mineral trioxide aggregate on sealing ability of root-end fillings in vitro. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2004, 97(1): 108–111.
7. Torabinejad M, Rastegar AF, Kettering JD, Pitt Ford TR. Bacterial leakage of mineral trioxide aggregate as a root-end filling material. J Endod, 1995, 21(3): 109–112.
8. Fischer EJ, Arens DE, Miller CH. Bacterial leakage of mineral trioxide aggregate as compared with zinc-free amalgam, intermediate restorative material, and Super-EBA as a root-end filling material. J Endod, 1998, 24(3): 176–179.
9. Torabinejad M, Parirokh M. Mineral trioxide aggregate: a comprehensive literature review – part II: leakage and biocompatibility investigations. J Endod, 2010, 36(2): 190–202.
10. Mandava P, Bolla N, Thumu J, Vemuri S, Chukka S. Microleakage evaluation around retrograde filling materials prepared using conventional and ultrasonic techniques.
J Clin Diagn Res, 2015, 9(2): 43–46.
11. Tobon-Arroyave SI, Restrepo-Perez MM, Arismendi- Echavarria JA, Velasquez-Restrepo Z, Marin- Botero ML, Garcia-Dorado EC. Ex vivo microscopic assessment of factors affecting the quality of apical seal created by root-end fillings. Int Endod J, 2007, 40(8): 590–602.
12. Gondim E, Zaia AA, Gomes BP, Ferraz CC, Teixeira FB, Souza-Filho FJ. Investigation of the marginal adaptation of root-end filling materials in root-end cavities prepared with ultrasonic tips. I Endod J, 2003, 36(7): 491–499.
13. Duarte MAH, Bramante CM, De Deus G. Clinical applications. In: Camilleri J, editor. Mineral trioxide aggregate in dentistry. Springer, 2014, 1. vydání, 103–130.
14. Fuss Z, Trope M. Root perforations: classification and treatment choices based on prognostic factors.
Endod & Dent Traumatol, 1996, 12(6): 255–264.
15. Haapasalo M, Parhar M, Huang X, Wei X, Lin J, Shen Y. Clinical use of bioceramic materials. Endod Topics, 2015, 32(1): 97–117.
16. Ree M, Schwartz R. Management of perforations: four cases from two private practices with medium- to long-term recalls. J Endod, 2012, 38(10): 1422–1427.
17. Juarez Broon N, Bramante CM, de Assis GF, Bortoluzzi EA, Bernardineli N, de Moraes IG, et al. Healing of root perforations treated with Mineral Trioxide Aggregate (MTA) and Portland cement. J Appl Oral Sci, 2006, 14(5): 305–311.
18. Holland R, Filho JA, de Souza V, Nery MJ, Bernabe PF, Junior ED. Mineral trioxide aggregate repair of lateral root perforations. J Endod, 2001, 27(4): 281–284.
19. Main C, Mirzayan N, Shabahang S, Torabinejad M. Repair of root perforations using mineral trioxide aggregate: a long-term study. J Endod, 2004. 30(2): 80–83.
20. Ford TR, Torabinejad M, McKendry DJ, Hong CU, Kariyawasam SP. Use of mineral trioxide aggregate for repair of furcal perforations. Oral Surg Oral Med, Oral Pathol Oral Radiol Endod, 1995, 79(6): 756–763.
21. Torabinejad M, Lemon R. Use of MTA as Root Perforation Repair. In: Torabinejad M, editor. Mineral trioxide aggregate: properties and clinical application. John Wiley & Sons, 2014, 1. vydání, 177–206.
22. Lemon RR. Nonsurgical repair of perforation defects. Internal matrix concept. Dent Clin North Am, 1992, 36(2): 439–457.
23. DeLong C, He J, Woodmansey KF. The effect of obturation technique on the push-out bond strength of calcium silicate sealers. J Endod, 2015, 41(3): 385–388.
24. Hess D, Solomon E, Spears R, He J. Retreatability of a bioceramic root canal sealing material. J Endod, 2011, 37(11): 1547–1549.
25. Kim H, Kim E, Lee SJ, Shin SJ. Comparisons of the retreatment efficacy of calcium silicate and epoxy resin-based sealers and residual sealer in dentinal tubules. J Endod, 2015, 41(12): 2025–2030.
26. Ersev H, Yilmaz B, Dincol ME, Daglaroglu R. The efficacy of ProTaper Universal rotary retreatment instrumentation to remove single gutta-percha cones cemented with several endodontic sealers. Int Endod J, 2012, 45(8): 756–762.
27. Bogen G, Kuttler S. Mineral trioxide aggregate obturation: a review and case series. J Endod, 2009, 35(6): 777–790.
28. Bogen G, Lawaty I, Chandler N. MTA Root Canal Obturation. In: Torabinejad M, editor. Mineral trioxide aggregate: properties and clinical applications. John Wiley & Sons, 1. vydání, 2014, 207–250.
29. Giovarruscio M, Uccioli U, Malentacca A, Koller G, Foschi F, Mannocci F. A technique for placement of apical MTA plugs using modified Thermafil carriers for the filling of canals with wide apices. Int Endod J, 2013, 46(1): 88–97.
30. Aminoshariae A, Hartwell GR, Moon PC. Placement of mineral trioxide aggregate using two different techniques. J Endod, 2003, 29(10): 679–682.
31. El-Ma’aita AM, Qualtrough AJ, Watts DC. A micro-computed tomography evaluation of mineral trioxide aggregate root canal fillings. J Endod, 2012, 38(5): 670–672.
32. Yeung P, Liewehr FR, Moon PC. A quantitative comparison of the fill density of MTA produced by two placement techniques. J Endod, 2006, 32(5): 456–9.
33. Basturk FB, Nekoofar MH, Gunday M, Dummer PM. The effect of various mixing and placement techniques on the compressive strength of mineral trioxide aggregate. J Endod, 2013, 39(1): 111–114.
34. Araujo AC, Nunes E, Fonseca AA, Cortes MI, Horta MC, Silveira FF. Influence of smear layer removal and application mode of MTA on the marginal adaptation in immature teeth: a SEM analysis. Dent Traumatol, 2013, 29(3): 212–217.
35. Lawley GR, Schindler WG, Walker WA 3rd, Kolodrubetz D. Evaluation of ultrasonically placed MTA and fracture resistance with intracanal composite resin in a model of apexification. J Endod, 2004, 30(3): 167–172.
36. Alhaddad Alhamoui F, Steffen H, Splieth CH. The sealing ability of ProRoot MTA when placed as an apical barrier using three different techniques: an in-vitro apexification model. Quintessence Int, 2014, 45(10): 821–827.
37. Basturk FB, Nekoofar MH, Gunday M, Dummer PM. Effect of various mixing and placement techniques on the flexural strength and porosity of mineral trioxide aggregate. J Endod, 2014, 40(3): 441–445.
38. Parashos P, Phoon A, Sathorn C. Effect of ultrasonication on physical properties of mineral trioxide aggregate. Biomed Res Int, 2014, 2014: 191984.
39. Žižka R, Škrdlant J, Míšová E. Maturogeneze. LKS, 2015, 25(11): 220–228.
40. de Leimburg ML, Angeretti A, Ceruti P, Lendini M, Pasqualini D, Berutti E. MTA obturation of pulpless teeth with open apices: bacterial leakage as detected by polymerase chain reaction assay. J Endod, 2004, 30(12): 883–886.
41. Matt GD, Thorpe JR, Strother JM, McClanahan SB. Comparative study of white and gray mineral trioxide aggregate (MTA) simulating a one- or two-step apical barrier technique. J Endod, 2004, 30(12): 876–879.
42. Martin RL, Monticelli F, Brackett WW, Loushine RJ, Rockman RA, Ferrari M, et al. Sealing properties of mineral trioxide aggregate orthograde apical plugs and root fillings in an in vitro apexification model. J Endod, 2007, 33(3): 272–275.
43. De Bruyne MA, De Moor RJ. Influence of cracks on leakage and obturation efficiency of root-end filling materials after ultrasonic preparation: an in vitro evaluation. Quintessence Int, 2008, 39(8): 685–692.
44. Storm B, Eichmiller FC, Tordik PA, Goodell GG. Setting expansion of gray and white mineral trioxide aggregate and Portland cement. J Endod, 2008, 34(1): 80–82.
45. Hawley M, Webb TD, Goodell GG. Effect of varying water- to-powder ratios on the setting expansion of white and gray mineral trioxide aggregate.
J Endod, 2010, 36(8): 1377–1379.
46. Fong CD, Davis MJ. Partial pulpotomy for immature permanent teeth, its present and future.
Pediatr Dent, 2002, 24(1): 29–32.
47. Orstavik D. Essential Endodontology.
Blackwell, Oxford, 1998, 192–210.
48. Aeinehchi M, Eslami B, Ghanbariha M, Saffar AS. Mineral trioxide aggregate (MTA) and calcium hydroxide as pulp- capping agents in human teeth: a preliminary report. Int Endod J, 2003, 36(3): 225–231.
49. Bogen G, Kim JS, Bakland LK. Direct pulp capping with mineral trioxide aggregate: an observational study. J Ame Dent As, 2008, 139(3): 305–315, quiz 305–315.
50. Mente J, Geletneky B, Ohle M, Koch MJ, Friedrich Ding PG, Wolff D, et al. Mineral trioxide aggregate or calcium hydroxide direct pulp capping: an analysis of the clinical treatment outcome. J Endod, 2010, 36(5): 806–813.
51. Miles JP, Gluskin AH, Chambers D, Peters OA. Pulp capping with mineral trioxide aggregate (MTA): a retrospective analysis of carious pulp exposures treated by undergraduate dental students. Oper Dent, 2010, 35(1): 20–28.
52. Berman LH, Hargreaves KM, Cohen SR. Cohen´s Pathway To Pulp. 11th ed., Elsevier, 2015, 1–44.
53. Matsuo T, Nakanishi T, Shimizu H, Ebisu S. A clinical study of direct pulp capping applied to carious-exposed pulps. J Endod, 1996, 22(10): 551–556.
54. Hafez AA, Cox CF, Tarim B, Otsuki M, Akimoto N.
An in vivo evaluation of hemorrhage control using sodium hypochlorite and direct capping with a one- or two-component adhesive system in exposed nonhuman primate pulps. Quintessence Int, 2002, 33(4): 261–272.
55. Demir T, Cehreli ZC. Clinical and radiographic evaluation of adhesive pulp capping in primary molars following hemostasis with 1.25% sodium hypochlorite: 2-year results.
Am J Dent, 2007, 20(3): 182–188.
56. Sarkar NK, Caicedo R, Ritwik P, Moiseyeva R, Kawashima I. Physicochemical basis of the biologic properties of mineral trioxide aggregate. J Endod, 2005, 31(2): 97–100.
57. Islam I, Chng HK, Yap AU. Comparison of the physical and mechanical properties of MTA and portland cement.
J Endod, 2006, 32(3): 193–197.
58. Nekoofar MH, Adusei G, Sheykhrezae MS, Hayes SJ, Bryant ST, Dummer PM. The effect of condensation pressure on selected physical properties of mineral trioxide aggregate. Int Endod J, 2007, 40(6): 453–461.
59. Kinney JH, Marshall SJ, Marshall GW. The mechanical properties of human dentin: a critical review and re-evaluation of the dental literature. Crit Rev Oral Biol Med, 2003, 14(1): 13–29.
60. Butt N, Talwar S, Chaudhry S, Nawal RR, Yadav S, Bali A. Comparison of physical and mechanical properties of mineral trioxide aggregate and Biodentine. Indian J Dent Res, 2014, 25(6): 692–697.
61. Duggal M. Formocresol alternatives. Br Dent J, 2009, 206(1): 3.
62. Zealand CM, Briskie DM, Botero TM, Boynton JR, Hu JC. Comparing gray mineral trioxide aggregate and diluted formocresol in pulpotomized human primary molars. Pediatr Dent, 2010, 32(5): 393–399.
63. Fuks AB, Papagiannoulis L. Pulpotomy in primary teeth: review of the literature according to standardized criteria. Eur Arch Paediatr Dent, 2006, 7(2): 64–71; discussion 2.
64. Farsi N, Alamoudi N, Balto K, Mushayt A. Success of mineral trioxide aggregate in pulpotomized primary molars. J Clin Pediatr Dent, 2005, 29(4): 307–311.
65. Erdem AP, Guven Y, Balli B, Ilhan B, Sepet E, Ulukapi I, et al. Success rates of mineral trioxide aggregate, ferric sulfate, and formocresol pulpotomies: a 24-month study. J Pediatr Dent, 2011, 33(2): 165–170.
66. Ansari G, Ranjpour M. Mineral trioxide aggregate and formocresol pulpotomy of primary teeth: a 2-year follow-up. Int Endod J, 2010, 43(5): 413–418.
67. Liu H, Zhou Q, Qin M. Mineral trioxide aggregate versus calcium hydroxide for pulpotomy in primary molars.
Chin J Dent Res, 2011, 14(2): 121–125.
68. Moretti AB, Sakai VT, Oliveira TM, Fornetti AP, Santos CF, Machado MA, et al. The effectiveness of mineral trioxide aggregate, calcium hydroxide and formocresol for pulpotomies in primary teeth. Int Endod J, 2008, 41(7): 547–555.
69. Dammaschke T, Camp JH, Bogen G.
MTA in Vital Pulp Therapy. In: Torabinejad M, editor. Mineral trioxide aggregate: properties and clinical applications. John Wiley & Sons, 2014, 71–110.
70. Nair PN, Duncan HF, Pitt Ford TR, Luder HU. Histological, ultrastructural and quantitative investigations on the response of healthy human pulps to experimental capping with mineral trioxide aggregate: a randomized controlled trial. Int Endod J, 2008, 41(2): 128–150.
71. Dominguez MS, Witherspoon DE, Gutmann JL, Opperman LA. Histological and scanning electron microscopy assessment of various vital pulp-therapy materials.
J Endod, 2003, 29(5): 324–333.
72. Chacko V, Kurikose S. Human pulpal response to mineral trioxide aggregate (MTA): a histologic study.
J Clin Pediatr Dent, 2006, 30(3): 203–209.
73. Mitchell DF, Tarplee RE. Painful pulpitis; a clinical and microscopic study. Oral Surg Oral Med Oral Pathol, 1960, 13: 1360–1370.
74. Seltzer S, Bender IB, Ziontz M. The dynamics of pulp inflammation: correlations between diagnostic data and actual histologic findings in the pulp. Oral Surg Oral Med Oral Pathol, 1963, 16: 969–977.
75. Zerlotti E. Histochemical changes in the connective tissue of the dental pulp during inflammation. Oral Surg Oral Med Oral Pathol, 1969, 27(5): 664–677.
76. Eghbal MJ, Asgary S, Baglue RA, Parirokh M, Ghoddusi J. MTA pulpotomy of human permanent molars with irreversible pulpitis. Aust Endod J, 2009, 35(1): 4–8.
77. Nosrat A, Seifi A, Asgary S. Pulpotomy in caries-exposed immature permanent molars using calcium-enriched mixture cement or mineral trioxide aggregate: a randomized clinical trial. Int J Paediatr Dent, 2013, 23(1): 56–63.
78. Asgary S, Eghbal MJ. Treatment outcomes of pulpotomy in permanent molars with irreversible pulpitis using biomaterials: a multi-center randomized controlled trial. Acta Odont Scand, 2013, 71(1): 130–136.
79. Banchs F, Trope M. Revascularization of immature permanent teeth with apical periodontitis: new treatment protocol? J Endod, 2004, 30(4): 196–200.
80. Kohli MR, Yamaguchi M, Setzer FC, Karabucak B. Spectrophotometric analysis of coronal tooth discoloration induced by various bioceramic cements and other endodontic materials. J Endod, 2015, 41(11): 1862–1866.
81. Shokouhinejad N, Nekoofar MH, Pirmoazen S, Shamshiri AR, Dummer PM. Evaluation and comparison of occurrence of tooth discoloration after the application of various calcium silicate-based cements: an ex vivo study. J Endod, 2016, 42(1): 140–144.
82. Marconyak LJ Jr., Kirkpatrick TC, Roberts HW, Roberts MD, Aparicio A, Himel VT, et al. A comparison of coronal tooth discoloration elicited by various endodontic reparative materials. J Endod, 2016, 42(3): 470–473.
83. Felman D, Parashos P. Coronal tooth discoloration and white mineral trioxide aggregate. J Endod, 2013, 39(4): 484–487.
84. Beatty H, Svec T. Quantifying coronal tooth discoloration caused by biodentine and endosequence root repair material. J Endod, 2015, 41(12): 2036–2039.
15. 3. 2018
Print: LKS. 2018; 28(3): 60 – 67
Autoři:
Fotografie
- Radovan Žižka
Rubrika:
Téma: